2. Термодинамика растворов электролитов. Типы ДЭС
2. Термодинамика растворов электролитов. Типы ДЭС
На границе раздела фаз электрод – раствор происходит перераспределение зарядов, в результате которого у поверхности электрода накапливается избыток ионов какого-либо одного знака, в результате на поверхности возникает избыток зарядов противоположного знака. Такое пространство разделения избыточных зарядов позволяет ввести понятие ДЭС. Условно можно представить две воображаемые плоскости, которые проходят через центры тяжести избыточных зарядов в поверхностном слое на электроде и раствора у поверхности электрода.
Расстояние между плоскостями равно диаметру сольватированного комплекса (d). Таким образом, ДЭС можно рассматривать как плоский конденсатор:
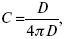
D – диэлектрическая проницаемость, для Н2О = 80, d = 10–8 – расстояние между обкладками. Перераспределяемый заряд на границе раздела фаз имеет динамическое преобладание.
Согласно закону термодинамики, перенос вещества из одной фазы в другую характеризуется химическим потенциалом
? = ?Gхим
? зависит от концентрации частиц.
? = ?0 +RTlnС,
где С – концентрация частиц, участвующих в реакции переноса;
?0– стандартное значение потенциала при С= 1.
Согласно термодинамике, перенос вещества из одной фазы в другую происходит таким образом, что химический потенциал вещества действует до тех пор, пока ?1 = ?2 в обеих фазах.
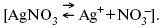
Определяющимися ионами являются ионы Ag+, следовательно, если химический ? ионов Ag (Ме),
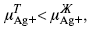
то, согласно уравнению Ле-Шателье, перенос ионов Ag+, в сторону раствора будет происходить с большей скоростью, чем в обратном направлении, в результате количество ионов Ag у поверхности будет увеличиваться, так как концентрация в растворе растет.
?Ag+ = ?0 + RT lnCAg+.
Перенос происходит до тех пор, пока
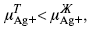
Когда наступит равенство ?, скорость переноса в обоих направлениях через границу раздела фаз становится одинаковой.
Наступает равновесие; так как в переносе принимают участие заряженные частицы, то в этом случае говорят об электрохимическом равновесии. При установлении равновесия поверхность, с которой ушли Ag+, приобретает избыток отрицательного заряда, под действием его избыток положительных зарядов собирается в растворе у поверхности.
Возникновение избытка заряда приводит к возникновению скачка ?на границе раздела фаз. Согласно представлению о плоском конденсаторе, скачок потенциала изменяется линейно с расстоянием от поверхности электрода. Емкость такого плоского конденсатора, когда ионная обкладка ДЭС состоит из катионов, составляет С = 20 МКФ/см2.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
4. Термодинамика
4. Термодинамика Нельзя закончить этот краткий очерк истории развития классической физики, не сказав несколько слов о науке, которая целиком была создана учеными XIX в., о термодинамике.В XVIII в. теплота представлялась в виде некоторой жидкости, общее количество которой
ЛЕКЦИЯ № 2. Химическая термодинамика
ЛЕКЦИЯ № 2. Химическая термодинамика Химическая термодинамика – наука, изучающая условия устойчивости систем и законы.Термодинамика – наука о макросистемах.Она позволяет apriori определить принципиальную невозможность того или иного процесса. Физические и химические
1. Общая характеристика растворов
1. Общая характеристика растворов Растворы – термодинамически устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это дисперсные системы, состоящие из дисперсной фазы и дисперсионной среды. Различают девять
1. Ассоциации в растворах электролитов. Понятие о теории сильных электролитов. Активность
1. Ассоциации в растворах электролитов. Понятие о теории сильных электролитов. Активность При увеличении концентрации растворов электролитов создаются условия, когда за счет электростатического взаимодействия становится возможным образование новых соединений –
3. Современные подходы к описанию термодинамических свойств растворов электролитов
3. Современные подходы к описанию термодинамических свойств растворов электролитов При теоретическом подходе к концентрированным растворам электролитов предпринимались попытки уточнить классическую модель теории Дебая – Хюккеля за счет учета следующих эффектов:1)
4. Термодинамические характеристики ионов в растворах электролитов
4. Термодинамические характеристики ионов в растворах электролитов ?i– химический потенциал иона. где ??изменение поверхностного потенциала данного раствора по сравнению с поверхностным потенциалом стандартного раствора;аi– «реальная» активность иона. где ln?i–
Глава IV Мощность и типы ядерных бомб
Глава IV Мощность и типы ядерных бомб I. Увеличение мощности ядерных бомб Как уже говорилось выше, первые ядерные бомбы были сброшены в августе 1945 года. В каких же размерах увеличилась с того времени их мощность?1. Даты основных ядерных взрывов.Истекшие десять лет можно
III. Типы и мощность ядерных бомб
III. Типы и мощность ядерных бомб Устройство ядерных бомб постоянно совершенствовалось, а их мощность возрастала.1. Атомные бомбы.а) Типы бомб.Как мы уже говорили, бомба, сброшенная на Хиросиму, в качестве заряда имела уран 235. Во всех остальных бомбах, основанных на делении
24. Термодинамика
24. Термодинамика Под термодинамикой понимают раздел физики, рассматривающий системы, между которыми возможен обмен энергией без учета микроскопического строения тел, составляющих систему. Различают термодинамику равновесных систем (или систем, переходящих к
ТИПЫ КОЛЛАЙДЕРОВ
ТИПЫ КОЛЛАЙДЕРОВ Итак, столкновение двух пучков позволяет получить более высокие энергии (а значит, исследовать меньшие расстояния), чем эксперименты с неподвижной мишенью, поэтому мы выбираем коллайдер. Возникает следующий вопрос: что сталкивать? Этот вопрос порождает
Кипение растворов
Кипение растворов Явление кипения растворов имеет много общего с явлением замерзания.Наличие растворенного вещества затрудняет кристаллизацию. По тем же самым причинам растворенное вещество затрудняет и кипение. В обоих случаях чужие молекулы как бы борются за