2. Уравнения электрохимической кинетики, пределы их применимости
2. Уравнения электрохимической кинетики, пределы их применимости
1-й закон Фарадея устанавливает прямую пропорциональность между количеством прошедшего через систему электричества и количеством прореагировавшего вещества.
?m = kэJt = kэq, (1)
где ?m – количество прореагировавшего вещества;
k – коэффициент пропорциональности;
q – количество электричества, равное произведению силы тока I на время t.
Если q = Jt = 1, то ?m = kэ – количество вещества, прореагировавшего в результате протекания единицы количества электричества.
kэ – электрохимический эквивалент.
2-й закон Фарадея устанавливает связь между количеством прореагировавшего вещества при пропускании данного количества электричества и его природой.
По этому закону, при постоянном количестве прошедшего электричества массы прореагировавших веществ относятся между собой, как их химические эквиваленты А:
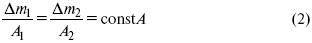
Если количество электричества равно F, числу Фарадея, то ?m1 = Fkэ1 = A1, Fkэ при q = 1F, то
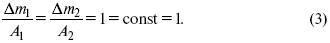
Уравнение (3) позволяет объединить оба закона Фарадея в виде одного общего закона, по которому количество электричества (1F = 96500k) всегда изменяет электрохимически массу любого вещества, независимо от его природы.
Законы Фарадея – основные законы электролиза, согласно которых, количество вещества, выделившегося при электролизе, прямо пропорционально его химическому эквиваленту и количеству прошедшего электричества.
Уравнение Нернста
Е0 – равновесный стандартный потенциал.
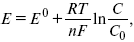
где С0 – стандартная концентрация раствора;
С – любая концентрация в нестандартных условиях, С = С0 x Е = Е0 , т. е. в стандартных условиях С = C0 = 1 моль.
Для окислительных веществ
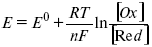
1-й закон Фика:
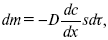
где dc/dx – градиент концентрации;
s – площадь, через которую происходит диффузия.
? – коэффициент диффузии cм2 x c-1, показывает число частиц, продиффундировавших за 1 с через поперечное сечение раствора площадью 1 см2, dt – время диффузии, dm – число продиффундировавших частиц.
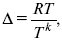
где Тк – коэффициент внутреннего трения;
D – коэффициент диффузии.
Первый закон Фика относится к процессу стационарной диффузии, сходен с закономерностями переноса тепла из электричества.
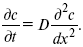
Если диффузионный поток не изменяется с течением времени, это называется стационарной диффузией.
Диффузия – самопроизвольно протекающий в системе процесс выравнивания концентрации молекул, ионов, частиц под влиянием теплового хаотического движения.
Основное уравнение электрохимической кинетики
ik = ia = i0,
где i0 – ток обмена,

(окислительно-восстановительные реакции).
При катодной поляризации на электроде через систему протекает ik преимущественно, если поляризация не слишком велика, то суммарная скорость процесса равна:
i = ik – ia,
для реакции (1) катодные и анодные токи будут равны:
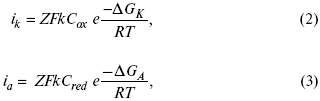
где Z – количество электронов, участвующих в реакции;
F – число Фарадея;
к – const скорости;
Сox, Cred – концентрация окислительной и восстановленной форм реагентов;
?GK – энергия активации катодного процесса;
?GA – энергия активации анодного процесса.
Энергия активации зависит от величины накладываемого потенциала, в то же самое время эта энергия распределяется между прямой и обратной реакцией в соответствии с коэффициентом переноса – а, т. е.
? = ?пр – ?об.
Коэффициент переноса ?– доля энергии электрического поля в ДЭС, которая приходится на прямую и обратную реакции.
?– коэффициент переноса для катодной реакции;
(1 – ?) – для анодного процесса (коэффициент переноса).
?Gk = ZFE ?, (4)
?GA = ZFE(1 – ?) (5)
С учетом уравнений (4), (5) уравнения (2), (3) примут следующий вид:
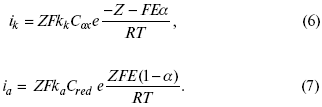
Различие знаков у электрона объясняется тем, что катодная поляризация («–») ускоряет прямую реакцию и замедляет обратную реакцию.
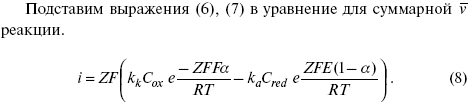
Введем в уравнение (8) плотность тока обмена – i0.
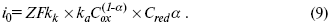
Вместо потенциала введем перенапряжение:
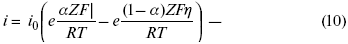
полное уравнение поляризационной кривой.
Вывод из уравнения (10):
1) при равновесном потенциале, когда ток равен нулю, уравнение (10) преобразуется в уравнение Нернста:
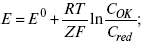
2) при малых величинах ?:
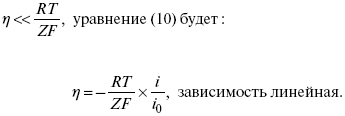
При сдвижении потенциала от равновесного (59 mВ);
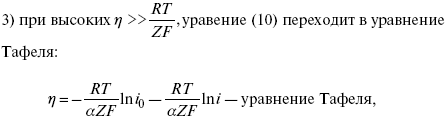
? = a + b ln i– уравнение Тафеля в простом виде при замедлении стадии переноса заряда.
Величина i0 (тока обмена) и ?(коэффициента переноса) – основные кинетические параметры стадии переноса заряда (q). Они могут быть определены из экспериментальных измерений, для этого на исследуемом электроде снимают зависимость ?– i или Ei – i.
Поляризационная кривая судит о коррозионной стойкости металлов.
Перестраиваем поляризационную кривую в координаты:
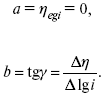
Определяем const а и bв уравнении Тафеля, определяем b:
Из коэффициента bнайдем а, после подставим в а и найдем i0.
Перенапряжение Н2 (водорода).
Источник выделения Н2 – Н2SO4 ?Н++ НSO4–
Источник выделения Н2 – Н2О ? Н++ ОН-.
В рН < 7 Н2 выделяется по реакции.
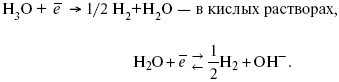
Н2 всегда выделяется в потенциалах более отрицательных, чем равновесный потенциал, то есть с перенапряжением.
Суммарный процесс выделения водорода состоит из следующих стадий:
1) доставка к поверхности катода реагирующих частиц Н3О+;
2) разряд Н3О+ с образованием Надс
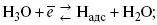
3) удаление выделяющегося Надс с поверхности электрода может происходить тремя путями:
а) каталитическая рекомбинация
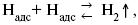
где Кat – материал катода;
б) электрохимическая десорбция – удаление Н2 происходит на уже адсорбированных атомах
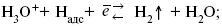
в) эмиссия включает две стадии:
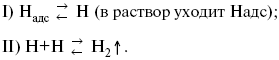
Для Pt замедлена стадия а), для других металлов (Hg, Pb) – стадия разряда, Н+ – самый подвижный.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
3. Уравнения изохоры, изобары химической реакции
3. Уравнения изохоры, изобары химической реакции Зависимость К от температуры Уравнение изобары: Уравнение изохоры: По ним судят о направлении протекания
1. Понятие химической кинетики
1. Понятие химической кинетики Кинетика – наука о скоростях химических реакций.Скорость химической реакции – число элементарных актов химического взаимодействия, протекающих в единицу времени в единицу объема (гомогенные) или на единице поверхности
ЭЛЕКТРОМАГНИТНЫЙ МЕТОД И ПРЕДЕЛЫ ЕГО ПРИМЕНИМОСТИ
ЭЛЕКТРОМАГНИТНЫЙ МЕТОД И ПРЕДЕЛЫ ЕГО ПРИМЕНИМОСТИ 9.28. Существование нерадиоактивных изотопов впервые было доказано при изучении ионизованных молекул газа, движущихся в электрическом и магнитном полях. Это — поля, которые являются основой так называемого