III
III
Изучение горения лучше всего начать с какого-нибудь простого случая. Свеча для этого нам не годится — слишком много побочных факторов сопутствуют химической реакции горения. Топливо сначала должно расплавиться, затем подняться по фитилю, испариться и лишь потом, смешавшись с кислородом воздуха, сгореть. Вспомним слова Фарадея: "Как можно что-нибудь изучать, когда мешают трудности, не относящиеся к делу?"
Целесообразно начать с горения газов. Это связано с тем, что газовые химические реакции лучше изучены, чем реакции в конденсированных телах или на их поверхности. Кроме того, и многие физические процессы (теплопроводность, диффузия) в газовых системах мы можем рассчитывать лучше, чем в твердом теле или жидкости.
Пусть в некотором сосуде находится смесь газов, способная к экзотермической реакции. Если температура газа достаточно низка (например, комнатная), то лишь небольшая доля молекул может вступить в химическую реакцию. Для многих горючих смесей скорость реакции при комнатной температуре столь ничтожна, что они могут сохраняться очень долго. Повысим теперь температуру газа — возрастет скорость химической реакции, а вместе с нею и скорость выделения тепла. Это приведет к дальнейшему, уже самопроизвольному нагреву газа за счет его химической энергии. Если бы не было потерь энергии через стенки сосуда, то произошел бы, как обычно говорят, тепловой взрыв. Повышение температуры вело бы к росту скорости химической реакции, а рост скорости реакции к увеличению температуры. Скорость этого процесса очень быстро возрастает во времени, так что он носит взрывной характер. Повышение температуры газа после завершения реакции пропорционально тепловому эффекту.
При учете потерь энергии газа через стенки сосуда могут осуществиться два случая. Если размеры сосуда достаточно велики, то теплопотери малы по сравнению с тепловыделением за счет химической реакции. Действительно, скорость выделения энергии пропорциональна объему сосуда, т. е. кубу его линейного размера, а теплопотери — поверхности, которая пропорциональна квадрату линейного размера.
Увеличение объема сосуда снижает роль теплопотерь. Взрыв будет происходить, но менее бурно, чем в неограниченном сосуде. Если же роль теплопотерь велика (небольшой объем газа), то взрыв не успеет развиться — после некоторого повышения температуры газа устанавливается стационарный режим, при котором тепловыделение равно теплопотерям и реакция идет с почти постоянной, обычно малой, скоростью.
Необходимо отметить, что переход от невзрывного, медленного протекания реакции ко взрыву носит резкий характер. Достаточно лишь на немного увеличить размер сосуда или температуру окружающей среды, как течение реакции радикально меняется. Это один из примеров существования критических условий в горении.
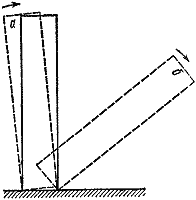
Рис. 3.
Можно привести много примеров критических условий. Самые наглядные и понятные из них механические. Поставим на стол кость от домино (рис. 3). Если наклонить ее на угол, меньший некоторого, то предоставленная самой себе она вернется в начальное положение (а). В противном случае исход опыта будет совсем иным (б). Читатели, знакомые с принципом действия атомного реактора, вспомнят, конечно, что там критические условия связаны с равенством скорости выделения нейтронов в объеме реактора и скорости их поглощения и вылета из реагирующей среды. Есть критические условия и в животном мире. Чем крупнее животное, тем меньше у него отношение поверхности тела к его объему. У небольших животных потеря тепла на единицу массы очень велика, поэтому нужна очень высокая интенсивность обмена веществ. Это обстоятельство ставит предел уменьшению размеров тела теплокровного животного. Если человеку для поддержания жизни достаточно в сутки потреблять количество пищи, составляющее процент от его массы, то самое мелкое млекопитающее (землеройка массой три-пять граммов должно ежесуточно поглощать количество пищи, равное массе животного.
В рассмотренной выше постановке опыта скорость химической реакции почти постоянна по объему сосуда, поэтому тепловой взрыв охватывает весь газ. Представим теперь, что в достаточно широкой трубе находится смесь газов А и В, которые могут реагировать с выделением некоторого количества тепла Q:
А + В ? K + L + Q.
Если газ холодный, то скорость реакции ничтожна, и смесь будет находиться в трубе сколь угодно долго. Нагревая газ у одного конца трубы, можно вызвать местное воспламенение смеси. Выделившееся при этом тепло будет передаваться соседним, холодным слоям газа, что приведет к распространению реакции вдоль трубы.
Если смесь прореагировала в одном конце трубы (скажем, в правом), то по ее длине будет меняться не только температура, но и концентрации исходных А и В и конечных К и L продуктов. Неравномерность температуры приводит к процессу теплопроводности, т. е. к передаче тепла от уже прореагировавших объемов газа к свежей, холодной смеси. Из-за переменности концентраций возникает явление диффузии — молекулярный перенос вещества из областей с большой его концентрацией в те места, где оно находится в недостатке. Исходные вещества диффундируют направо, конечные — налево, в несгоревшую смесь. Процессы диффузии и теплопроводности сглаживают распределения температур и концентраций. Между свежей смесью и продуктами горения появляется зона, где присутствуют конечные продукты, а температура повышена, несмотря на то, что химическая реакция здесь не идет. На левом конце этой зоны, называемой областью подогрева, температура близка к начальной температуре T0, а на правом — к температуре горения T1. Концентрация же исходного вещества падает слева направо и в конце зоны подогрева во много раз меньше начальной. Схематически распределение концентраций и температуры по длине трубы изображено на рис. 4.
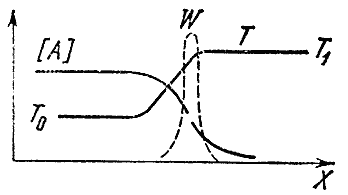
Рис. 4.
Где происходит химическая реакция? Мы знаем, что ее скорость зависит от концентрации исходных веществ и температуры. Слева большая концентрация, но низкая температура, справа — наоборот. Вспомним теперь, что скорость реакции очень сильно зависит от температуры и гораздо слабее от концентрации реагирующих веществ. Поэтому можно утверждать, что максимальная скорость химической реакции достигается в том месте, где температура наивысшая, т. е. равна T1. Прерывистой линией на рисунке нанесена скорость реакции W в фронте пламени. Кривая имеет резкий максимум при T1. Левее реакция не идет, так как там мала температура, правее — из-за нулевой концентрации исходных веществ. Таким образом, наличие диффузии конечных продуктов реакции в исходную смесь приводит к тому, что реакция в основном идет в том месте, где исходное вещество сильно разбавлено продуктами реакции.
Приведем опять механическую аналогию. Расставим теперь в ряд много косточек от домино (рис. 5, а). Если они находятся не слишком далеко друг от друга, то достаточно уронить одну, чтобы "прореагировали" и соседние (рис. 5, б). Аналогия достаточно глубокая. Здесь можно различить и "свежую смесь", способную к реакции, но находящуюся в устойчивом состоянии (вертикально стоящие кости), "прореагировавшие" газы (лежащие кости), и "зону реакции" (падающие косточки). Так же как и в процессе горения, здесь распространяется "волна падения", которая движется со вполне определенной скоростью.
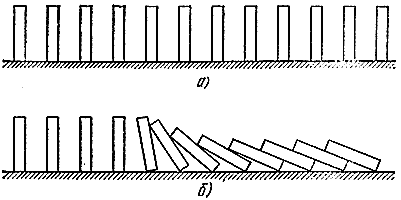
Рис. 5.
Однако вернемся к газу. Проследим за судьбой некоторой порции свежей смеси. Зона химической реакции, называемая фронтом пламени (он обычно светится, так как газы нагреты), движется справа налево, поэтому выбранный нами объем газа рано или поздно попадает в зону подогрева, где он разбавляется продуктами горения и нагревается за счет тепла сгоревших ранее порций газа. Попадая же во фронт пламени и сгорая в нем, он выделяет тепло, которое идет не на саморазогрев (температура во фронте максимальна), а на нагрев следующих порций свежей смеси. Таким образом, тепловая энергия берется в долг, который погашается в процессе сгорания.
Хотя химические реакции при температурах горения порядка двух тысяч градусов протекают очень быстро, скорость распространения пламени обычно мала — порядка десятков сантиметров в секунду. Это связано с тем, что существенным элементом процесса горения является перенос тепла, который идет с незначительной скоростью.
Мы уже упоминали, что распространение пламени по трубе возможно лишь при достаточно большом ее диаметре. Если диаметр мал, то в игру вступают теплопотери из зоны реакции в стенки трубы. Существует минимальный (критический) диаметр, при котором пламя уже не может себя поддерживать — происходит срыв горения. Для обычных газовых смесей, скажем, водорода или природного газа с воздухом, значение критического диаметра составляет один-два миллиметра. Это свойство пламени и использовал Дэви в изобретенной им безопасной лампе. Медная металлическая сетка с ячейками, размер которых меньше критического, не позволяет пламени проникнуть из лампы во внешнюю среду.
На этом мы закончим рассмотрение простейшего случая горения заранее перемешанных газов. Упомянем только, что именно его демонстрировал на своих лекциях Фарадей, когда проводил удивительно красивый опыт зажигания свечи на расстоянии. От фитиля только что погашенной свечи поднимается тонкая струйка пара, который, перемешиваясь с воздухом, образует горючую смесь. Пламя от горящей лучинки проскакивает по этому огневоду к еще не успевшему остыть фитилю и зажигает свечу.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.