Строение атома и Периодический закон Д.И. Менделеева
Массовое число (А) – общее число протонов и нейтронов в атомном ядре:
A = N(p0) + N(p+).
Заряд ядра атома (Z) равен числу протонов в ядре и числу электронов в атоме:
Z = N(p+) = N(e?).
Изотопы – атомы одного элемента, различающиеся числом нейтронов в ядре, например: калий-39: 39К (19р+, 20п0, 19е?); калий-40: 40К (19р+, 21п0, 19е?).
*Энергетические уровни и подуровни
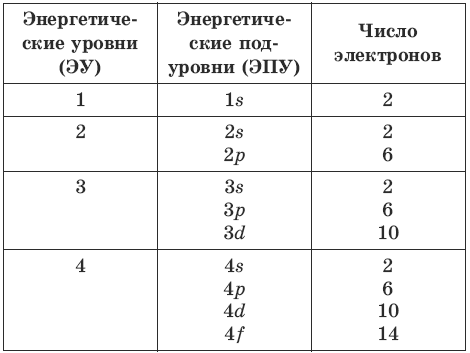
*Атомная орбиталь (АО) характеризует область пространства, в которой вероятность пребывания электрона, имеющего определенную энергию, является наибольшей.
*Формы s– и р-орбиталей

Периодический закон и Периодическая система Д.И. Менделеева
Свойства элементов и их соединений периодически повторяются с возрастанием порядкового номера, который равен заряду ядра атома элемента.
Номер периода соответствует числу энергетических уровней, заполненных электронами, и обозначает последний по заполнению энергетический уровень (ЭУ).
Номер группы А показывает число валентных электронов ns и пр.
Номер группы Б показывает число валентных электронов ns и (п – 1)d.
Секция s-элементов – заполняется электронами энергетический подуровень (ЭПУ) ns-ЭПУ – IA– и IIА-группы, Н и Не.
Секция р-элементов – заполняется электронами np-ЭПУ – IIIA-VIIIA-группы.
Секция d-элементов – заполняется электронами (п-1)d-ЭПУ – IБ-VIIIБ2-группы.
Секция f-элементов – заполняется электронами (п-2)f-ЭПУ – лантаноиды и актиноиды.
Изменение состава и свойств водородных соединений элементов 3-го периода Периодической системы
Нелетучие, разлагаются водой: NaH, MgH2, AlH3.
Летучие: SiH4, PH3, H2S, HCl.
Изменение состава и свойств высших оксидов и гидроксидов элементов 3-го периода Периодической системы
Осн?вные: Na2O – NaOH, MgO – Mg(OH)2.
Амфотерные: Al2O3 – Al(OH)3.
Кислотные: SiO2 – H4SiO4, P2O5 – H3PO4, SO3 – H2SO4, Cl2O7 – HClO4.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.