4. Растворы неэлектролитов. Закон Рауля и его следствия
4. Растворы неэлектролитов. Закон Рауля и его следствия
Рассмотрим модель идеального раствора. Раствор называется идеальным, если в нем отсутствует взаимодействие между частицами (молекулами, атомами, ионами). Растворы неэлектролитов – частицы, плохо растворимые в воде, так как нет носителя электрического заряда. Закон Рауля справедлив только для разбавленных растворов неэлектролитов.
Пусть PBO – давление пара над чистым растворителем, при постоянной температуре T1; PB – давление пара растворителя при этой же температуре, но над раствором, состоящим из нелетучего компонента А (сахар), и чистым жидким растворителем В:
PB = f (T).
Разность PBO – PB равна понижению давления пара.
Величина (PBO – PB) /PBO – относительное понижение упругости пара = XA = ?P/PBO, где XA – мольная доля, PBO > PB, ?P = PBO – PB – абсолютное понижение упругости пара.
Закон Рауля. Относительное понижение упругости пара растворителя над раствором равно мольной доле растворенного нелетучего компонента.
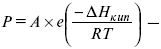
барометрическая формула Больцмана.
Следствия из закона Рауля:
1. Растворение нелетучего компонента в растворителе приводит к расширению температурной области существования жидкой фазы.
2. Понижение температуры замерзания и повышение температуры кипения прямо пропорциональны моляльной концентрации растворенного вещества.
3. Растворы, содержащие одинаковое число молей растворенных веществ в одинаковых молях растворителя, обнаруживают одно и то же понижение температуры замерзания и одно и то же повышение температуры кипения.
?tкип=Э x Смоляльн,
где Э – эбуллиоскопическая константа, +0,52.
?tзам=К x Смоляльн,
где К – криоскопическая константа, равная –1,86.
Эбуллиоскопическая константа – разница между температурой кипения раствора и температурой чистого растворителя.
Криоскопическая константа – разница между температурой замерзания раствора и температурой чистого растворителя.
Для решения задач об этих константах необходимо знать массу растворенного вещества и массу раствора. Например, масса хлороформа (трихлорметан CHCl3) рассчитывается по формуле:
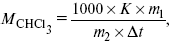
где m1 – масса растворенного вещества;
m2 – масса растворителя;
?t – величина, показывающая на сколько градусов понизилась температура;
К – криоскопическая константа.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Закон инерции
Закон инерции Из принципа относительности движения вытекает, что тело, на которое не действует никакая внешняя сила, может находиться не только в состоянии покоя, но и в состоянии прямолинейного равномерного движения. Это положение в физике называется законом
ЛЕКЦИЯ № 3. Растворы
ЛЕКЦИЯ № 3. Растворы 1. Общая характеристика растворов Растворы – термодинамически устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это дисперсные системы, состоящие из дисперсной фазы и дисперсионной
7. Закон Генри
7. Закон Генри Фугитивность растворителя в разбавленном растворе не зависит от природы растворенного вещества и вычисляется по закону Рауля, то есть: Так как фугитивность жидкости или твердого раствора равна фугитивности насыщенного пара, когда растворитель в
2. Закон Гесса
2. Закон Гесса При изобарных и изохорных условиях теплота является функцией состояния.В 1840 г. Г. Н. Гесс формулирует закон: «Тепловой эффект химической реакции не зависит от промежуточных стадий, а зависит только от начального и конечного состояния системы».?QP = dH,?QV = dUвн,QP =
6. Следствия теории относительности
6. Следствия теории относительности 6.1. Время жизни Рассмотрим изменение времени жизни элементарных частиц, например, космических ?-мезонов, возникающих в результате взаимодействия космических лучей с атмосферой Земли.<…>Искусственные мезоны движутся сравнительно
Закон Мэрфи
Закон Мэрфи Дональд МИЧИ Я думаю, что самое глубокое и прочное впечатление в своей жизни каждый научный работник получает от того, как неожиданно, как несправедливо, как удручающе трудно хоть что-нибудь открыть или доказать. Многих осложнений и разочарований можно было
Закон Архимеда
Закон Архимеда Подвесим гири к безмену. Пружина растянется и покажет вес гири. Не снимая гири с безмена, опустим ее в воду. Изменится ли показание безмена? Да, вес тела как бы уменьшится. Если опыт проделать с килограммовой железной гирей, то «уменьшение» веса составит
Закон Авогадро
Закон Авогадро Пусть вещество представляет собой смесь различных молекул. Нет ли такой физической величины, характеризующей движение, которая была бы одинакова для всех этих молекул, например для водорода и кислорода, находящихся при одинаковой температуре?Механика
XIII. Растворы
XIII. Растворы Что такое раствор Если посолить бульон и размешать ложкой, то не останется и следов соли. Не следует думать, что крупинок соли просто не видно невооруженным глазом. Кристаллики соли никаким способом не удастся обнаружить по той причине, что они растворились.
Твердые растворы
Твердые растворы В жизни слово «раствор» применяют к жидкостям. Однако существуют и твердые смеси, атомы или молекулы которых однородно перемешаны. Но как получить твердые растворы? При помощи пестика и ступки их не получишь. Поэтому смешивающиеся вещества надо сначала
Как замерзают растворы
Как замерзают растворы Если охладить раствор какой-либо соли в воде, то обнаружится, что температура замерзания понизилась. Нуль градусов пройден, а затвердевание не происходит. Только при температуре на несколько градусов ниже нуля в жидкости появятся кристаллики. Это
Закон преломления
Закон преломления В работе Dioptrique Декарт излагает свою теорию света, основанную на вихрях, и обсуждает законы отражения и преломления, впервые выразив принцип, что отношение углов падения и преломления зависит от среды, через которую проходит свет.Уже греки знали, что
Закон Рэлея
Закон Рэлея К концу 1899 г. были проведены более точные измерения в области более длинных волн, которые показали, что в этой области закон Вина уже несправедлив. В июне того же года лорд Рэлей (который был при рождении Джоном Вильямом Стрэтгом (1842-1919)) опубликовал вывод закона
СЛЕДСТВИЯ ДИАМАГНЕТИЗМА: РОЖДЕНИЕ КВАНТОВОЙ МЕХАНИКИ
СЛЕДСТВИЯ ДИАМАГНЕТИЗМА: РОЖДЕНИЕ КВАНТОВОЙ МЕХАНИКИ «Теперь мы уже готовы к рассмотрению теории индуцированного магнетизма с той точки зрения, которой, как я полагаю, придерживался Фарадей. Когда магнитная сила действует на произвольную среду, магнитную, диамагнитную