ЛЕКЦИЯ № 3. Растворы
ЛЕКЦИЯ № 3. Растворы
1. Общая характеристика растворов
Растворы – термодинамически устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это дисперсные системы, состоящие из дисперсной фазы и дисперсионной среды. Различают девять систем (табл. 1):
Таблица 1
Дисперсные системы
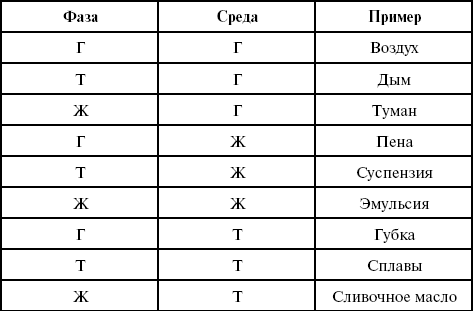
где Г – газ;
Т – твердое тело;
Ж – жидкость.
Существуют жидкие, газовые и твердые растворы. Растворы отличаются от химических соединений тем, что их состав может изменяться непрерывно. Как и любая химически равновесная в данных условиях система, растворы должны обладать минимумом свободной энергии Гиббса. По своему агрегатному состоянию дисперсные системы могут быть: газообразными, жидкими, твердыми; по степени дисперсности – взвесями, коллоидными и истинными растворами. Взвеси – гетерогенные системы, нестабильные во времени. Частицы их очень малы и сохраняют все свойства фазы. Взвеси расслаиваются, причем диспергированная фаза или выпадает в виде осадка, или всплывает в зависимости от соотношения плотностей. Примеры: туман (жидкость распределена в газе), суспензия (твердое тело – жидкость), эмульсия (жидкость – жидкость, C2H5OH + H2O – этиловый спирт и вода).
В истинном растворе распределенное в среде вещество диспергировано до атомного или молекулярного уровня. Примеры многочисленны: газообразный раствор – воздух, состоящий из главного компонента азота – 78% N2; сплавы, представляющие собой твердые растворы, например, медные Cu – Zn, Cu – Cd, Cu – Ni и др.
Коллоидные растворы – микрогетерогенные системы, занимают промежуточное положение между истинными растворами и взвесями. Растворы состоят из растворенного вещества и растворителя. Растворителем считают тот компонент, который преобладает в растворе. Свойства растворов зависят от концентрации. Рассмотрим способы выражения концентрации растворов.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Лекция 5. Различие прошлого и будущего
Лекция 5. Различие прошлого и будущего Каждому ясно. что события, происходящие в нашем мире, явно необратимы. Другими словами, все происходит так, а не наоборот. Роняешь чашку, она разбивается, и сколько ни жди, черепки не соберутся снова и чашка не прыгнет обратно тебе в
ЛЕКЦИЯ № 2. Химическая термодинамика
ЛЕКЦИЯ № 2. Химическая термодинамика Химическая термодинамика – наука, изучающая условия устойчивости систем и законы.Термодинамика – наука о макросистемах.Она позволяет apriori определить принципиальную невозможность того или иного процесса. Физические и химические
4. Растворы неэлектролитов. Закон Рауля и его следствия
4. Растворы неэлектролитов. Закон Рауля и его следствия Рассмотрим модель идеального раствора. Раствор называется идеальным, если в нем отсутствует взаимодействие между частицами (молекулами, атомами, ионами). Растворы неэлектролитов – частицы, плохо растворимые в воде,
ЛЕКЦИЯ № 4. Катализ
ЛЕКЦИЯ № 4. Катализ 1. История открытия явления катализа Катализ – изменение скорости химической реакции в присутствии катализаторов. Самые простые научные сведения о катализе были известны уже к началу XIX в. Знаменитый русский химик, академик К. С. Кирхгоф, открыл в 1811 г.
ЛЕКЦИЯ № 5. Химическое равновесие
ЛЕКЦИЯ № 5. Химическое равновесие 1. Понятие химического равновесия. Закон действующих масс При протекании химической реакции через некоторое время устанавливается химическое равновесие. Существует два признака химического равновесия: кинетический,
ЛЕКЦИЯ № 6. Химическая кинетика
ЛЕКЦИЯ № 6. Химическая кинетика 1. Понятие химической кинетики Кинетика – наука о скоростях химических реакций.Скорость химической реакции – число элементарных актов химического взаимодействия, протекающих в единицу времени в единицу объема (гомогенные) или на единице
ЛЕКЦИЯ № 7. Коррозия металлов
ЛЕКЦИЯ № 7. Коррозия металлов 1. Основные понятия и терминология Коррозия – самопроизвольное окисление металлов, вредное для промышленной практики (уменьшающее долговечность изделий). Это слово произошло от латинского corrodere – разъедать. Среда, в которой металл
ЛЕКЦИЯ № 8. Физико-химический анализ
ЛЕКЦИЯ № 8. Физико-химический анализ 1. Суть физико-химического анализа Задача физико-химического анализа состоит в установлении зависимости свойств равновесной системы от параметров состояния. Под параметрами состояния обычно понимают: состав, давление, температуру.
ЛЕКЦИЯ № 9. Термохимия
ЛЕКЦИЯ № 9. Термохимия 1. Понятие термохимии Раздел физической химии и химической термодинамики, изучающий тепловые процессы теплоемкости веществ, называется термохимией.?Q = dU + ?A– первый закон термодинамики. ?Q – не является функцией состояния. P = const || V = const – функции
ЛЕКЦИЯ № 10. Гальванические элементы
ЛЕКЦИЯ № 10. Гальванические элементы 1. Понятие гальванического элемента Гальванический элемент – прибор, который преобразовывает химическую энергию в электрическую. Одним из таких элементов является элемент Даниэля – Якоби. Этот элемент состоит из двух электродов:
ЛЕКЦИЯ № 11. Электрохимия
ЛЕКЦИЯ № 11. Электрохимия 1. Понятие электрохимии Электрохимия – раздел физической химии, который рассматривает системы, содержащие ионы (растворы или расплавы электролитов) и процессы, протекающие на границе двух фаз с участием заряженных частиц.Первые представления о
ЛЕКЦИЯ № 12. Теоретическая электрохимия
ЛЕКЦИЯ № 12. Теоретическая электрохимия 1. Ассоциации в растворах электролитов. Понятие о теории сильных электролитов. Активность При увеличении концентрации растворов электролитов создаются условия, когда за счет электростатического взаимодействия становится
ЛЕКЦИЯ № 13. Электрохимическая кинетика
ЛЕКЦИЯ № 13. Электрохимическая кинетика 1. Основные кинетические характеристики и методы их расчетов i0 – ток обмена – кинетическая характеристика равновесия между электродом и раствором при равновесном значении электродного потенциала. Токи обмена относят к 1 см2
XIII. Растворы
XIII. Растворы Что такое раствор Если посолить бульон и размешать ложкой, то не останется и следов соли. Не следует думать, что крупинок соли просто не видно невооруженным глазом. Кристаллики соли никаким способом не удастся обнаружить по той причине, что они растворились.
Твердые растворы
Твердые растворы В жизни слово «раствор» применяют к жидкостям. Однако существуют и твердые смеси, атомы или молекулы которых однородно перемешаны. Но как получить твердые растворы? При помощи пестика и ступки их не получишь. Поэтому смешивающиеся вещества надо сначала
Как замерзают растворы
Как замерзают растворы Если охладить раствор какой-либо соли в воде, то обнаружится, что температура замерзания понизилась. Нуль градусов пройден, а затвердевание не происходит. Только при температуре на несколько градусов ниже нуля в жидкости появятся кристаллики. Это