2. Механизм каталитического взаимодействия. Виды катализаторов
2. Механизм каталитического взаимодействия. Виды катализаторов
Различают гомогенный и гетерогенный катализ. При однородном (гомогенном) катализе катализатор и реагенты образуют однородную систему.
Пример:
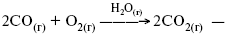
представляют однородную газовую фазу. Границы раздела между катализатором и реагентом отсутствуют. При гетерогенном – катализатор и реагирующие вещества находятся в разных фазах и отделены границей раздела. При этом катализатором является твердое тело, а реагенты находятся либо в газовой, либо в жидкой фазе. Пример:
N2(г) + 3H2(г) ? 2NH3(г).
Существует еще микрогетерогенный катализ, при котором катализатор находится в коллоидном или в высокомолекулярном состоянии.
Пример – биокаталитический процесс, катализаторами служат ферменты (энзимы). Есть еще автокаталитические процессы, когда катализатор – продукт самой реакции.
Рассмотрим механизм каталитического взаимодействия в общих чертах. Пусть дана некая химическая реакция
А + В = АВ.
Без катализатора она протекает медленно. Как же она будет протекать с катализатором, по какой схеме? Ответим на данные вопросы. Катализатор взаимодействует с одним из реагентов, образуя промежуточные соединения по реакции
А + К = АК.
Затем уже это соединение реагирует с другим исходным веществом, при этом образуется продукт реакции АВ и выделяется еще катализатор. Напомним, катализатор – вещество, активно участ-вующее в химической реакции, но регенерирующееся (восстанав-ливающееся) после ее завершения, что мы и наблюдаем в ходе реакции
АК + В = АВ + К.
Главное преимущество катализатора в том, что он уменьшает энергию активации, увеличивая скорость реакции, но не влияет на термодинамические величины: ?U, ?H, ?S, ?G, ?F.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Глава 36 МЕХАНИЗМ ЗРЕНИЯ
Глава 36 МЕХАНИЗМ ЗРЕНИЯ § 1. Ощущение цвета§ 2. Физиология зрения§ 3. Палочки§ 4. Сложные глаза насекомых§ 5. Другие типы глаз§ 6. Нервные механизмы зрения§ 1. Ощущение цветаОбсуждая механизм зрения, прежде всего необходимо понять, что мы обычно видим не беспорядочный набор
ПРОЧНОСТЬ ТВЕРДЫХ ТЕЛ И МЕХАНИЗМ ИХ ДЕФОРМАЦИИ
ПРОЧНОСТЬ ТВЕРДЫХ ТЕЛ И МЕХАНИЗМ ИХ ДЕФОРМАЦИИ Огромный вклад в эту чрезвычайно важную область физики внесли работы академика Абрама Федоровича Иоффе и его учеников.Большинство твердых тел имеет кристаллическую структуру. Долгое время в физике господствовали
Сильные и слабые взаимодействия
Сильные и слабые взаимодействия Открытие ядерного поля не разрешило сразу все нерешенные проблемы. Возникло недоумение по поводу времени взаимодействия мезона. Пролетая мимо ядра практически со скоростью света, ?-мезон находится все же достаточно близко от него и в
3. Виды коррозионных разрушений
3. Виды коррозионных разрушений Коррозия, в зависимости от природы металла, агрессивной среды и других условий, приводит к различным видам разрушений. На рисунке 13 представлены разрезы через прокорродировавший образец металла, показывающие возможные изменения рельефа
2. Различные виды молниеотводов
2. Различные виды молниеотводов Существуют различные способы защиты от молнии. Мы уже кратко говорили о тех защитных мероприятиях, которые применяются на линиях передач электрической энергии. Теперь посмотрим, как защищать от грозовых разрядов здания и различные другие
Механизм появления интерференции
Механизм появления интерференции Ученые всегда стремятся познать не только конечный и видимый результат, но и скрытые внутренние связи, протекающие в данном объекте, механизм, посредством которого реализуется результат. Это помогает им разобраться в наблюдаемом
В ПОИСКАХ ПЕРЕНОСЧИКОВ СЛАБОГО ВЗАИМОДЕЙСТВИЯ
В ПОИСКАХ ПЕРЕНОСЧИКОВ СЛАБОГО ВЗАИМОДЕЙСТВИЯ Прежде чем закончить разговор о том, как распознаются частицы Стандартной модели, рассмотрим последнюю их группу — слабые калибровочные бозоны: два W и один ?, переносящие слабое ядерное взаимодействие. Слабые калибровочные
МЕХАНИЗМ ХИГГСА
МЕХАНИЗМ ХИГГСА Ни один физик не сомневается в том, что на изученных нами до сих пор энергиях Стандартная модель работает. Результаты экспериментов согласуются с ее прогнозами с высокой точностью — лучше 1%.Однако Стандартная модель полагается на один ингредиент,
Механизм работы науки
Механизм работы науки Успех науки в изучении Вселенной складывается из наблюдений и выдвижения идей. Такого рода взаимообмен именуют научным методом (рис. 1.2). Рис. 1.2. Научный методВ ходе наблюдения то или иное явление воспринимается органами чувств при помощи приборов
3.5. Динамика тел в Главном поясе. Механизм переноса вещества в область планет земной группы
3.5. Динамика тел в Главном поясе. Механизм переноса вещества в область планет земной группы Главный пояс астероидов — образование, имеющее сложную динамическую структуру. Эта структура в основном определяется силами, действующими на малые тела в этой области со стороны
VIII. ВИДЫ ГЕОЦЕНТРИЧЕСКОЙ СИСТЕМЫ
VIII. ВИДЫ ГЕОЦЕНТРИЧЕСКОЙ СИСТЕМЫ Мы видели, что система Филолая заключает в себе представление о движении Земли вокруг центрального огня и вокруг своей оси. Но вращение Земли считается происходящим вокруг оси, которая перпендикулярна к плоскости ее суточного