Глава 10 1/2 Часть предыдущей лекции, которую проспал мистер Томпкинс
Глава 10 1/2
Часть предыдущей лекции, которую проспал мистер Томпкинс
В 1908 г. английский физик Джон Дальтон открыл закон кратных отношений. Он показал, что относительные пропорции различных химических элементов, необходимых для образования более сложных химических веществ, всегда могут быть выражены как отношения целых чисел и объяснил свой закон тем, что все сложные химические вещества состоят из различного числа частиц, соответствующих простым химическим элементам. Безуспешные попытки средневековой алхимии превратить один химический элемент в другой служат еще одним доказательством кажущейся неделимости мельчайших частиц вещества, которые без особых колебаний были названы своим древнегреческим именем — атомы. Данное единожды, это название закрепилось, и хотя теперь твердо установлено, что атомы Дальтона отнюдь не неделимы и в действительности состоят из большого числа более мелких, субатомных частиц, обычно мы предпочитаем закрывать глаза на филологическую непоследовательность этого названия.
Итак, то, что в современной физике принято называть атомами, отнюдь не является элементарными и неделимыми составными частями материи, о которых говорил в своих умозрительных построениях Демокрит, и термин «атом» был бы более обоснован применительно к более мелким субатомным частицам, таким как электроны и протоны, из которых состоят атомы Дальтона. Но такое изменение терминологии породило бы слишком большую путаницу, и ни один физик не заботится особенно о филологической непоследовательности существующей ныне терминологии. Поэтому мы употребляем старое название «атомы» в том же смысле, в каком его употреблял Дальтон, а электроны, протоны и другие субатомные единицы материи называем элементарными частицами.
Это название свидетельствует о том, что в настоящее время мы считаем эти субатомные частицы действительно элементарными и неделимыми в смысле Демокрита, и вы, естественно, можете спросить у меня, не повторится ли история и не выяснится ли в ходе дальнейшего развития современной физики, что так называемые элементарные частицы в действительности обладают весьма сложной внутренней структурой. Мой ответ состоит в том, что хотя нет абсолютной гарантии, что ничего такого не произойдет, имеются достаточно веские основания полагать, что на этот раз мы не ошиблись. Действительно, существуют девяносто две разновидности атомов (соответствующие девяносто двум различным химическим элементам), и каждый такой атом обладает весьма сложными характерными свойствами. В подобной ситуации само собой напрашивается упрощение — стремление свести сложную картину к более простой. С другой стороны, в современной физике известны лишь несколько различных типов элементарных частиц: электроны (отрицательно и положительно заряженные легкие частицы), нуклоны (заряженные или нейтральные тяжелые частицы, известные под названием протонов и нейтронов) и, возможно, так называемые нейтрино, природа которых полностью не выяснена.
Свойства этих элементарных частиц чрезвычайно просты, и дальнейшее деление материи не приведет к сколько-нибудь существенному упрощению. Кроме того, как вы понимаете, всегда необходимо иметь несколько элементарных понятий, с которыми можно было бы играть, если вы хотите построить нечто более сложное. Два или три таких элементарных понятия — отнюдь не много. Я считаю, что вы можете спокойно поставить последний доллар, держа пари, что элементарные частицы современной физики останутся достойными своего названия.
Но вернемся к вопросу о том, каким образом атомы Дальтона построены из элементарных частиц. Первый правильный ответ на этот вопрос был дан в 1911 г. знаменитым британским физиком Эрнестом Резерфордом (впоследствии Резерфорд лорд Нельсон). Резерфорд исследовал строение атома, бомбардируя различные атомы быстро движущимися крохотными снарядами, известными под названием альфа-частицы, испускаемыми при распаде радиоактивных элементов. Наблюдая за отклонениями (рассеянием) снарядов после прохождения кусочка материи (листочка фольги), Резерфорд пришел к выводу, что все атомы должны обладать очень плотной положительно заряженной сердцевиной (атомным ядром), окруженной гораздо более разреженным отрицательно заряженным облаком (атомной атмосферой). Ныне мы знаем, что атомное ядро состоит из определенного числа протонов и нейтронов, известных под собирательным названием нуклонов. Нуклоны тесно связаны между собой сильными силами сцепления. Атомная атмосфера состоит из различного числа отрицательно заряженных электронов, которые роем окружают атомное ядро под действием электростатического притяжения его положительного заряда. Число электронов, образующих атомную атмосферу, определяет все физические и химические свойства атома и изменяется вдоль естественной последовательности химических элементов от одного электрона (для водорода) до девяносто двух электронов (для самого тяжелого из известных элементов урана).
Несмотря на кажущуюся простоту атомной модели Резерфорда, ее детальный анализ оказался далеко не простым. Действительно, согласно одному из наиболее глубоко укоренившихся представлений классической физики, отрицательно заряженные электроны, обращаясь вокруг атомного ядра, должны терять свою энергию в виде испускаемого ими излучения (света). Как показывают вычисления, из-за постоянных потерь энергии все электроны, образующие атомную атмосферу, должны были бы за ничтожно малую долю секунды упасть на ядро. Это, казалось бы, вполне здравое рассуждение классической теории находится в резком противоречии с тем эмпирическим фактом, что атомные атмосферы очень стабильны и атомные электроны не падают на ядро, а бесконечно долго кружатся роем вокруг центрального тела. Таким образом, между основными представлениями классической механики и эмпирическими данными относительно механического поведения крохотных составных частей мира атомов возникает глубокое противоречие. Размышления над этим противоречием привели известного датского физика Нильса Бора к заключению, что классическая механика, на протяжении столетий претендовавшая на особое незыблемое положение в системе естественных наук, должна отныне рассматриваться как ограниченная теория, применимая к макроскопическому миру повседневного опыта, но утрачивающая силу при попытке применить ее к гораздо более тонким типам движения происходящего внутри различных атомов. В качестве пробного фундамента новой обобщенной механики, применимой и к движению крохотных подвижных частей атомного механизма, Бор предложил гипотезу о том, что из всего бесконечного разнообразия типов движения, рассматриваемых в классической механике, в природе реализуется только несколько специально выбранных типов. Эти разрешенные типы движения (называемые также разрешенными траекториями, или орбитами) отбираются в соответствии с определенными математическими условиями, известными под названием условий квантования в теории Бора. Я не стану входить здесь в подробное обсуждение этих условий квантования, но хочу лишь упомянуть об одном обстоятельстве: все эти условия выбраны таким образом, что налагаемые ими ограничения не имеют практического значения в тех случаях, когда масса движущейся частицы во много раз больше масс, с которыми мы встречаемся в структуре атома. Следовательно, применительно к макроскопическим телам новая микромеханика приводит к тем же результатам, что и старая классическая теория (принцип соответствия) и только при переходе к микроскопическим атомным механизмам разногласия между старой и новой теориями становятся существенными. Не вдаваясь в детали, я хочу удовлетворить ваше любопытство и продемонстрировать строение атома с точки зрения теории Бора, а именно схему расположения квантовых орбит в атоме по Бору (первый слайд, пожалуйста!). Вы видите (см. рис. на с. 163), разумеется, в сильно увеличенном масштабе, систему круговых и эллиптических орбит. Они представляют единственно «разрешенные» условиями квантования Бора типы движений для электронов, образующих атомную атмосферу. В то время как классическая механика разрешает электрону двигаться на любом расстоянии от ядра и не накладывает ограничений на эксцентриситет (т. е. на удлинение, или вытянутость) орбиты, разрешенные орбиты в теории Бора образуют дискретное множество с вполне определенными характерными размерами. Числа и латинские буквы, стоящие у каждой орбиты, указывают название соответствующей орбиты в общей классификации. Вы можете, например, заметить, что большие числа соответствуют орбитам с большими диаметрами.

Хотя предложенная Бором теория строения атома оказалась необычайно плодотворной для объяснения различных свойств атомов и молекул, основное понятие — дискретная квантовая орбита — оставалось весьма неясным, и чем глубже физики пытались вникнуть в анализ столь необычного ограничения классической теории, тем более неясной становилась общая картина.
Наконец, физики осознали, в чем именно заключается слабая сторона теории Бора: вместо основательной перестройки классической механики теория Бора просто наложила ограничения на ее результаты, введя дополнительные условия, в принципе чуждые всей структуре классической теории. Правильное решение всей проблемы было получено лишь тринадцать лет спустя в виде так называемой волновой механики, изменившей самые основы классической механики в соответствии с новым квантовым принципом. Несмотря на то, что на первый взгляд система волновой механики может показаться еще более «сумасшедшей», чем теория Бора, эта новая микромеханика представляет собой одну из наиболее последовательных и признанных частей современной теоретической физики. Поскольку фундаментальный принцип новой механики и, в частности, понятия «неопределенность» и «расплывание траекторий» были рассмотрены мной в одной из предыдущих лекций, я обращаюсь теперь к вашей памяти или к вашим конспектам и хотел бы вернуться к проблеме строения атома. На схеме, которую вы сейчас увидите (следующий слайд, пожалуйста!) (см. рис. внизу), изображено движение атомных электронов, рассматриваемое с позиций волновой механики, или с точки зрения «расплывания орбит». Вы видите здесь те же самые типы движения, которые в рамках классической теории были представлены на предыдущем слайде (единственное различие состоит лишь в том, что по чисто техническим причинам каждый тип движения теперь изображен отдельно), но вместо четких линий, изображающих траектории в теории Бора, теперь перед нами расплывчатые пятна в полном согласии с фундаментальным принципом неопределенности. Различные состояния движения имеют такие же обозначения, как на предыдущем слайде, и сравнивая оба слайда, вы заметите, если слегка напряжете воображение, что расплывчатые облака на втором слайде очень точно передают общие характерные особенности старых орбит Бора.
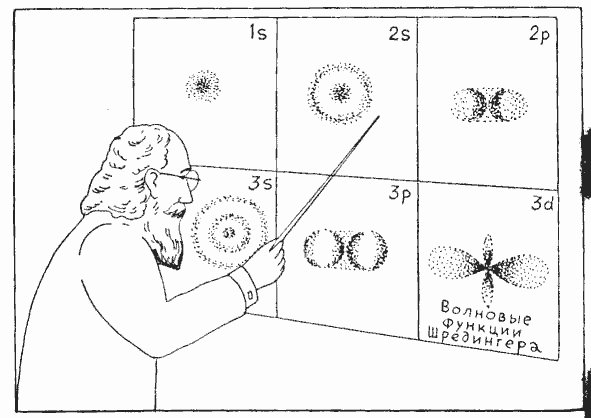
Оба слайда отчетливо показывают, что происходит с добрыми старомодными траекториями классической механики, когда в игру вступает квант, и хотя человеку непосвященному все это может показаться фантастическим сном, ученые, работающие в микрокосмосе атомов, не испытывают особых трудностей в восприятии такой картины.
Завершив на этом краткий обзор возможных состояний движения в электронной атмосфере атома, мы обращаемся теперь к важной проблеме, касающейся распределения различных атомных электронов по различным допустимым состояниям движения. Здесь мы сталкиваемся с новым принципом, совершенно незнакомым в макроскопическом мире. Этот принцип впервые был сформулирован моим молодым другом Вольфгангом Паули. Он утверждает, что в сообществе электронов данного атома никакие два электрона не обладают движением одного и того же типа. Это ограничение не имело бы особого значения, если бы число возможных движений было бесконечно велико, как в классической механике. Но поскольку правила квантования существенно уменьшают число «разрешенных» состояний движения, принцип Паули играет очень важную роль в атомном мире: он обеспечивает более или менее равномерное распределение электронов вокруг атомного ядра и мешает электронам скапливаться в каком-то одном месте.
Но из приведенной выше формулировки нового принципа не следует делать вывода о том, что расплывчатые квантовые состояния движения, изображенные на втором слайде, могут быть «заняты» только одним электроном. Действительно, помимо движения по орбите каждый электрон обладает спином, т.е. вращается вокруг собственной оси, и доктора Паули отнюдь не разочарует, если два электрона окажутся на одной орбите, если их спины будут направлены в противоположные стороны. Исследование спина электронов показывает, что скорость вращения электронов вокруг собственной оси всегда одна и та же и что направление спина всегда должно быть перпендикулярно плоскости орбит. Это означает, что возможны только два различных направления спина, которые соответственно можно считать происходящими «по часовой стрелке» и «против часовой стрелки».
Таким образом, применительно к квантовым состояниям принцип Паули может быть сформулирован следующим образом: в каждом квантовом состоянии движения могут находиться не более двух электронов, спины которых должны быть направлены в противоположные стороны. Проходя всю естественную последовательность элементов к атомам со все большим и большим числом электронов, мы обнаружим, что различные квантовые состояния движения постепенно заполняются электронами и диаметр атома монотонно возрастает. В этой связи нельзя не упомянуть о том, что с точки зрения силы связи различные квантовые состояния атомных электронов могут быть объединены в отдельные группы (или оболочки) с приблизительно равной силой связи. По мере продвижения вдоль естественной последовательности элементов, мы видим, что одна группа заполняется за другой и в результате последовательного заполнения электронных оболочек свойства атомов периодически изменяются. Это объясняет хорошо известную периодичность свойств элементов, открытую эмпирически знаменитым русским химиком Дмитрием Ивановичем Менделеевым.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Воспоминание о лекции профессора Френкеля
Воспоминание о лекции профессора Френкеля
НИКОЛА ТЕСЛА ЛЕКЦИИ СТАТЬИ
НИКОЛА ТЕСЛА ЛЕКЦИИ СТАТЬИ Посвящение к Белградскому изданию 1956 г.:Югославский Национальный Комитет по Празднованию Столетия со Дня Рождения Николы Теслы и Музей Николы Теслы в Белграде считают публикацию научных трудов Николы Теслы почетной обязанностью по отношению
Вопросы после лекции
Вопросы после лекции Вопрос: Вот было сказано о хиггсовском бозоне. Хиггсовское поле... Взаимосвязаны ли... Хиггсовский бозон — он... в чем именно интерес, чтобы...?Я забыл, действительно, сказать. Значит, смотрите. Хиггсовский бозон — это колебание этого хиггсовского поля,
Глава 3 Мистер Томпкинс берет отпуск
Глава 3 Мистер Томпкинс берет отпуск Мистеру Томпкинсу очень понравились приключения в релятивистском городе, огорчало только, что с ним не было профессора, который мог бы объяснить необычные явления, которые ему, мистеру Томпкинсу, довелось там наблюдать, например,