Глава шестая Опыты по химии
Глава шестая Опыты по химии
Мы уже не раз говорили о водороде. В этой главе, специально посвященной химии, поговорим об этом газе подробнее.
Если вы захотите делать химические опыты, запаситесь приборами. Все, что нужно для начала, — это несколько стеклянных трубок, 2–3 резиновые пробки с двумя отверстиями, воронка с трубкой, метр резиновой трубки и, пожалуй, еще стеклянная воронка и бумага для фильтрования. Специальную фильтровальную бумагу можно заменить обычной промокательной.
Запаситесь и некоторыми химическими материалами. Жидкости налейте в бутылки, порошки насыпьте в банки. Не имейте привычки сохранять материалы в картонных коробках. Конечно, каждый сосуд надо снабдить надписью с точным обозначением содержимого.
Добывание водорода. Чтобы добыть водород, бросьте в бутылку горсть цинковых стружек. На стружки налейте столько воды, чтобы они были покрыты ею. В горлышко бутылки вставьте пробку с двумя отверстиями. В одно из них вставьте трубку с воронкой, а в другое — отводную трубку, изогнутую коленом (рис. 139). Трубка с воронкой должна доходить почти до дна бутылки, во всяком случае конец ее должен быть покрыт водой.
Если вы вольете через воронку несколько граммов разбавленной серной кислоты, немедленно на цинковых стружках начнется сильное образование пузырьков водорода. Вытесняя воздух, водород станет наполнять бутылку.
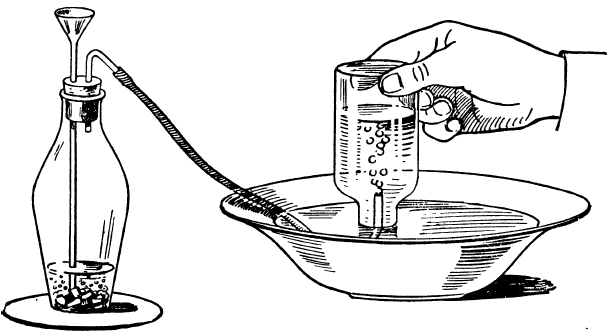
Рис. 139
Только не вздумайте поднести спичку к отверстию отводной трубки. Вспомните, что воздух состоит из азота и кислорода, а смесь водорода с кислородом — это опасный гремучий газ. Взрыв газа немедленно разорвал бы бутылку
Подождите несколько минут, пока весь воздух выйдет из бутылки, но и тогда еще будьте осторожны. С помощью резиновой трубки направьте газ в обыкновенный таз с водой. В таз опустите наполненную водой небольшую склянку горлышком вниз и введите конец резиновой трубки в горлышко этой склянки. Выходящий из трубки газ будет вытеснять воду и наконец заполнит всю бутылочку Тогда заткните ее под водой пальцем, выньте, переверните и быстро приблизьте к отверстию ее горящую спичку Газ вспыхнет и будет гореть голубоватым пламенем, если он чистый. Если вы услышите свист или треск, значит, к водороду все еще примешан воздух, и лучше, покрыв бутылочку картонкой, погасить газ, выпустить его весь и снова набрать чистый.
Когда вы убедитесь, что весь воздух из банки, в которой добывается газ, вышел, можно заменить резиновую трубку прямой заостренной стеклянной трубкой и спокойно зажечь водород прямо у этой трубки.
Водород горит почти бесцветным пламенем, но температура пламени очень высока. Через некоторое время пламя желтеет благодаря выделению натрия из стекла, накаливающегося на конце трубки.
Если у вас есть под рукой кусок старой сетки от ауэровской горелки, подержите его в пламени, и вы увидите ослепительный свет. Заостренный кусок мела тоже нагревается над пламенем добела.
Если подержать вертикально стеклянную длинную трубу большого диаметра, поместив внутрь ее это пламя, то столб воздуха в трубе начнет быстро колебаться, и труба зазвучит.
Если вы хотите, чтобы водород горел ярким пламенем, прибавьте к пламени угля. Маленькие частички его раскалятся и дадут сильный свет. В светильном газе, который проводится в квартиры, также имеется углерод. Углерод вы можете выделить из пламени светильного газа и получить его в виде копоти, подержав холодную тарелку над пламенем. Если материал, взятый вами для получения водорода, не совсем чист, то пламя, смотря по свойству материалов, окрашивается различно. Если вы возьмете цинк, содержащий фосфор или серу, чистую или нечистую серную кислоту, то пламя получит разную окраску — красноватую, голубоватую или желтую.
Если во время добывания водорода образование его в бутылке замедляется, влейте еще немного воды и кислоты, и вокруг цинковых стружек снова забурлят пузырьки. Но если жидкость стала серой и в ней плавают черные хлопья, дальнейшее добавление кислоты уже не поможет: значит, истрачен весь цинк. Нужно потушить пламя, разобрать всю установку, вычистить, вымыть и собрать снова.
Если жидкость уже полностью отработана, профильтруйте ее и слейте в маленький стаканчик. Вы позже получите здесь красивые продолговатые кристаллы, которые осядут на дно сосуда. Это цинковый купорос — соединение цинка с остатками серной кислоты после вытеснения водорода. Он очень ядовит.
Водород — самый легкий из известных нам газов, им чаще всего наполняют воздушные шары.
Интересно, что водород горит прекрасно, но сам горения не поддерживает. Если вы быстро введете в бутылку с водородом зажженный огарок свечи, прикрепленный к проволоке, водород загорится у горлышка, а огарок погаснет. Этот опыт показывает, что водород горит только тогда, когда он соединяется с кислородом. Если вы будете медленно поднимать и опускать огарок, его можно несколько раз зажечь у отверстия и потушить внутри бутылки.
Сохранять сосуды с водородом, даже хорошо закупоренные, нельзя. Уже через некоторое время в них проникает воздух и образует опасный гремучий газ.
Гремучий газ. Гремучий газ состоит из двух частей водорода и одной части кислорода. Опыты с ним нужно проводить очень осторожно.
Но есть один опыт, который производит большой эффект и вместе с тем совершенно безопасен.
Выдуйте мыльный пузырь большого диаметра и затем осторожно введите в него отводную трубку из бутылки, в которой образуется водород. Как вводить трубку в пузырь, чтобы он не разорвался, вы уже знаете по описанию опытов с мыльными пузырями. Когда вы введете достаточно водорода в пузырь, можно поднести к нему спичку, и он с громким треском разорвется.
Правда, в пузыре будет не чистый гремучий газ, а смесь водорода, кислорода, азота и выдыхаемой нами углекислоты, но все же опыт этот всегда хорошо удается.
Кислород. Вы знаете уже, что атмосферный воздух состоит из четырех частей азота и одной части кислорода. Эти два газа по-разному влияют на жизнедеятельность человека и животных. Азот останавливает жизнь, а кислород поддерживает. Но если бы мы вдыхали кислород слишком большими порциями, продолжительность нашей жизни сократилась бы.
Кислород очищает кровь в легких и занимает место выдыхаемого нами углекислого газа.
Добыть кислород можно, накаливая химические соединения, богатые кислородом. Проще всего добыть его, осторожно смешав на кусочке бумаги две части бертолетовой соли с одной частью порошка перекиси марганца. Небольшое количество этой смеси — не более 2 граммов — положите в колбочку и закупорьте ее пробкой с отводной трубкой. Колбочку поставьте на треножник из проволоки или из жести и нагрейте осторожно на спиртовой лампочке (рис. 140). Время от времени испытывайте выходящий газ тлеющей спичкой.
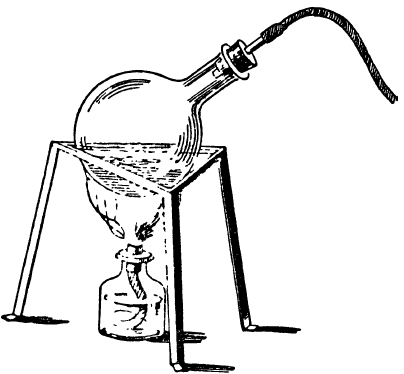
Рис. 140
Если тлеющая спичка вспыхнет в момент приближения к концу трубки, значит, из смеси стал выделяться кислород. Тогда наденьте на стеклянную трубку колбочки резиновую трубку и введите газ в бутылку таким же способом, как наполняли ее водородом. 2 грамма смеси бертолетовой соли с перекисью марганца дают немного кислорода, но в 4–5 приемов можно наполнить газом несколько довольно больших бутылок.
Кислород в бутылках можно сохранять для опытов некоторое время, только бутылки надо ставить горлышками вниз в блюда с водой. При добывании кислорода все-таки нужна некоторая осторожность. Кислород не взрывается, но иногда он образуется в колбочке так стремительно, что огонь спиртовки, получая добавочную порцию кислорода, охватывает колбу. Лучше держать лампочку все время в руке или на дощечке. Когда выделение газа чересчур ускорится, уберите спиртовку, а когда замедлится, снова подставьте ее под колбу. Искорки, появляющиеся в колбе при нагревании, — это сгорающие частицы пыли. Они не опасны, если число их не слишком велико. Когда вы добыли достаточное количество газа, уберите спиртовку, но не оставляйте резиновую трубку в тазу с водой. Вода поднимется в охлаждающуюся колбу, и колба может взорваться.
Кислород очень хорошо поддерживает горение. При большом количестве кислорода в воздухе сгорают даже такие тела, о возможности горения которых вы никогда не подозревали.
Для увеличения количества кислорода, притекающего к горящим веществам, устраивают поддувала; так, примерно, поддувают воздух в кузнечные горны, в доменные печи, где температура должна быть очень высокой. Все знают также, что ветер усиливает пожар.
Если вы наполните кислородом широкогорлую банку, затем закроете ее под водой плотно прилегающим кусочком картона или стеклом и перевернете, у вас будет сосуд, в котором можно пробовать, как горят различные тела в кислороде.
Привяжите, например, к проволоке кусочек тлеющего угля или губки и опустите в газ. Они ярко разгорятся и будут гореть до тех пор, пока либо сгорят окончательно, либо погаснут, если не хватит кислорода. Уголь горит в банке красноватым, а губка голубоватым пламенем. Очень красиво горит в кислороде сталь. Нагрев докрасна пружинку карманных часов, медленно охладите ее. От этого сталь отпустится, потеряет свою упругость. Выпрямите ее и к одному концу прикрепите кусочек губки. Зажгите затем губку. Опустите пружинку в бутылку с кислородом и закупорьте ее пробкой.
Сначала ярким пламенем разгорится тлеющая губка: она раскалит добела конец пружинки, и сталь загорится, бросая во все стороны замечательно красивые пучки искр. По мере того как пружинка будет сгорать, можно вдвигать ее через пробку. Конечно, опыт будет тем удачнее, чем больше сосуд с кислородом. На дно банки лучше насыпать немного песка, потому что летящие из пружины искры — это расплавленные маленькие шарики стали. Шарики вонзаются в стеклянную банку и даже могут разорвать ее.
Сера горит в кислороде голубым пламенем. При опытах с горением серы ее нельзя прицеплять к проволоке или пружинке — она будет стекать с них каплями. Для этого и для следующего опыта возьмите игрушечную ложечку из жести, согните ее и повесьте на проволоке в банку. Серу положите в ложку и нагрейте над спиртовкой, пока она не расплавится и не воспламенится. Затем быстро опустите ее в газ.
Очень интересен опыт сжигания фосфора в кислороде. Фосфор очень опасен, так как он даже на открытом воздухе воспламеняется сам собой. Хранить его нужно в воде и отрезать кусочки, также не вынимая из воды.
Достаньте кусочек фосфора величиной с горошину, выньте этот кусочек ножом из воды и, не снимая с ножа, высушите его промокательной бумагой, прежде чем положить в ложечку для сжигания. Только не дотрагивайтесь до фосфора пальцем — он дает сильные ожоги. Зажгите его нагретой проволокой и быстро опустите в банку, наполненную кислородом (рис. 141).

Рис. 141
Сила света при сгорании фосфора совершенно невыносима. Даже белое облако, окружающее горящий фосфор (пары фосфорной кислоты), так сильно светится, что только, пожалуй, солнечный свет сильнее. Если вы проделаете этот опыт вечером, вам покажется, будто все лампы погасли и яркий дневной свет исходит от фосфора. Тени, несмотря на другие источники света, кажутся резкими и черными.
Когда фосфор погаснет, вам покажется, что вы находитесь в темноте или ослепли, так как в первые минуты вы ничего не будете видеть, даже в хорошо освещенной комнате. Мало-помалу утомленные резким светом зрительные нервы привыкнут к «темноте», и окружающие предметы будут снова ясно видны.
Огонь под водой. Наполните стакан теплой водой и бросьте в нее кусочек фосфора. При соприкосновении с теплой водой фосфор моментально воспламеняется. Если затем вы начнете вдувать с помощью стеклянной трубки воздух к фосфору, вы заметите появление отскакивающих от него беспрерывно светящихся искорок.
Еще раз напоминаем об осторожном обращении с фосфором.
Как зажечь железо на открытом воздухе. Вы видели, как сталь накаляется в кислороде до температуры плавления. Вместо стали можно взять железо и заставить его гореть не в чистом кислороде, а в обыкновенном атмосферном воздухе. Конечно, сплошной кусок железа не будет гореть в воздухе, потому что для действия кислорода воздуха его поверхность слишком мала. Но если взять мелкие железные опилки, этим можно облегчить доступ кислорода к частицам железа и заставить их гореть.
Возьмите магнитом щепотку железных опилок — вы получите нечто вроде железной губки, пропитанной воздухом. Теперь вам остается только минуту подержать щепотку железа над пламенем.
Опилки быстро и равномерно раскалятся докрасна.
Опустите эту раскаленную щепотку в кислород, и вы получите прекрасный фейерверк.
Двуокись углерода, или углекислый газ, выдыхается животными и поглощается растениями, для питания которых он необходим. Углекислый газ тяжелее воздуха. Поэтому при добывании его не нужно столько приспособлений, как при добывании других газов, и хранить его можно просто в стаканах, прикрытых картонками.
Добыть углекислый газ можно в такой же банке, в какой добывали водород, только вместо цинка надо взять кусочки мела или мрамора и облить их разбавленной соляной кислотой.
Газ выделяется немедленно, потому что кислота энергично соединяется с известью (мрамор — это углекислая известь) и освобождает углекислый газ.
Выделениями углекислого газа знаменит так называемый Собачий грот близ Неаполя, на дне которого газ расстилается подобно озеру. В Германии тоже есть гроты, в которых выделяется двуокись углерода, например близ Пирмонта в Вестфалии.
Есть простое средство удостовериться в присутствии углекислого газа: пламя моментально гаснет в нем.
Если фонарь, внесенный в винный или пивной погреб, потухнет, надо быть очень осторожным — значит, в этом помещении много углекислого газа.
Как залить пламя невидимым газом. Понятно, что под названием «невидимый газ» мы подразумеваем углекислый газ. Прикрепите к картонке несколько свечей различной высоты, зажгите их и опустите на дно высокой банки. Впустите в банку углекислый газ с помощью длинной стеклянной трубки, доходящей до дна банки (рис. 142). Углекислый газ станет собираться на дне. Потом он поднимется и погасит одну свечу за другой, начав с самой короткой.
Так как двуокись углерода тяжелее воздуха, ее можно осторожно переливать из одного сосуда в другой. Чувствительные весы, на которые можно поставить два сосуда, наглядно покажут прибавление веса.
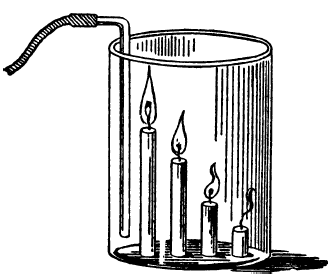
Рис. 142
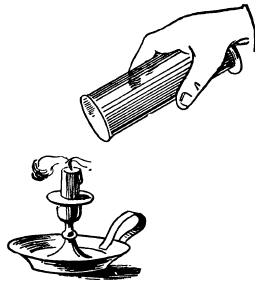
Рис. 143
Если вы выльете углекислый газ из стакана на пламя свечи, пламя съежится, а при большой массе газа свеча совсем потухнет, будто ее опустили в воду (рис. 143).
Превращение воды в жидкость молочного цвета. Опустите в стакан с водой несколько кусочков негашеной извести и размешайте. Часть извести растворится в воде. Отфильтруйте раствор. Вы получите светлую жидкость, которую можно сохранять для следующих опытов.
Если в эту, так называемую известковую воду впустить струю углекислого газа, вода тотчас же замутится и станет похожей на молоко.
Помутнение известковой воды — очень чувствительное средство для определения присутствия двуокиси углерода. Достаточно подышать через маленькую трубку в жидкость, чтобы она замутилась.
Превращение бесцветной жидкости в синюю, белую и красную. При химических соединениях всегда получаются новые вещества, свойства которых подчас резко отличаются от свойств составных веществ. Так, например, одно из свойств серы — горючесть, а железа — притягиваться магнитом.
Однако соединение обоих веществ — сернистое железо — не горит и не притягивается магнитом.
Прибавив несколько капель раствора азотнокислого серебра (ляписа) к соленой воде, мы получим творожистый осадок, совершенно безвредный, хотя ляпис сильно ядовитое вещество. Известны краски, составные части которых совершенно бесцветны. Есть также неокрашенные вещества, полученные соединением двух окрашенных.
Приготовьте три раствора таких веществ: 1) желтой кровяной соли, 2) ляписа и 3) роданистого калия. На 100 кубических сантиметров воды возьмите по несколько граммов этих веществ и налейте растворы их в склянки с надписями. В четвертой склянке приготовьте раствор хлорного железа такой концентрации, чтобы раствор был желтым.
Для опыта возьмите четыре стакана с водой. Прибавьте к ней по несколько капель из каждой склянки. Поставьте теперь три первых стакана в ряд: 1) кровяная соль, 2) ляпис и 3) роданистый калий, а четвертый стакан, в который влито несколько капель хлорного железа, поставьте в стороне. Подлейте теперь в первые три стакана прозрачной жидкости из четвертого. Тотчас же жидкости в стаканах окрасятся в синий, белый и красный цвет. Если вы покажете опыт своим товарищам, они, не зная вашего секрета, наверное, очень удивятся.
Превращение желтой жидкости в голубую. Налейте в большой сосуд побольше воды и растворите в ней 1 весовую часть индиго в порошке, 2 весовые части железного купороса и 3 весовые части негашеной извести. Сосуд закройте крышкой и оставьте в покое на несколько часов. Все вещества растворятся. Первоначально голубая окраска заменится желтой. Дайте твердым частицам осесть в воде и слейте желтую жидкость в глубокий сосуд.
При переливании цвет жидкости изменится, и в другой сосуд она будет наливаться темно-голубой. Окраска индиго зависит от количества поглощенного им кислорода, который окрашивает индиго в голубой цвет. Так как железный купорос отнимает часть кислорода, попадающего из воздуха, окраска индиго становится белой, а известь делает ее желтой. При соприкосновении с воздухом индиго получает достаточно кислорода, чтобы снова стать голубым.
Изменение окраски при нагревании. Растворите в воде медный купорос, сильно разбавив раствор. Теперь подливайте в слабый раствор медного купороса едкий калий до тех пор, пока при легком взбалтывании красивый голубой осадок не будет больше растворяться. Затем прибавьте в сосуд немного виноградного сахара. Это никак не повлияет на раствор. Но если вы нагреете в пробирке небольшое количество этой жидкости, она станет оранжевой или красной.
Такой же опыт можно проделать с раствором марганцовокислого калия в холодной воде. Сначала раствор калия зеленовато-синий, но, как только вы нагреете его до кипения, он станет светло-красным.
Превращение красной розы в белую, потом в зеленую и черную. Положите несколько красных роз под стеклянный колпак и под колпаком зажгите серу. В парах серы роза делается неприглядной, пестрой и, наконец, белой. Одну из этих роз окуните в слабый раствор серной кислоты, и она снова станет красной. Вторую розу опустите в раствор свинцового уксуса — она станет зеленой. Третью розу опустите сначала в слабый раствор соды, а затем в раствор железного купороса — она почернеет.
Если вы подставите под пары крепкой соляной кислоты влажные фиалки, они сделаются красными. Под парами нашатырного спирта фиалки станут зелеными, а под парами свинцовой извести с добавлением соляной кислоты — белыми.
Темно-голубые мальвы, как и розы, белеют в парах серы, становятся чудного красного цвета при добавлении серной кислоты в раствор свинцового сахара (очень ядовит). Обесцвеченные мальвы в поташе или содовом растворе делаются светло-зелеными и, наконец, в слабом растворе серной кислоты опять становятся красными.
Бенгальские огни. Бенгальскими называются огни, окрашенные в какой-нибудь цвет и получаемые при сжигании одного или нескольких смешанных веществ. Все смеси делаются в порошках, в известной пропорции — по весу или объему. Порошки употребляют или просто насыпанными на доску, или набитыми в бумажные гильзы. Тогда их называют свечами. В порошке состав дает больше света, а в свече меньше, потому что в свече уменьшается поверхность горения.
До смешивания отдельных веществ их надо предварительно хорошенько просушить, а затем растереть в мельчайший порошок. Порошки никогда не растирайте после смешивания веществ, особенно если в состав их входит бертолетова соль. Бертолетова соль очень легко взрывается, и ее даже отдельно надо растирать с предосторожностями, не просушивая и не сильно надавливая, с перерывами, чтобы она не нагревалась. Составы надо размешивать на картонке деревянной лопаточкой или палочкой.
Самые чистые и красивые огни — только красный, зеленый, да еще разве белый. Остальные выходят гораздо хуже.
Вот вещества, которые окрашивают пламя:
азотнокислый стронций — красный огонь;
хлористый натр, то есть поваренная соль, — желтый огонь;
азотнокислая окись меди или йодистая медь — зеленый огонь;
поташ — лиловый огонь.
Рецептов для составления различных цветных огней очень много, — это целая наука; мы укажем здесь только самые употребительные.
Белый огонь:
селитры………………………18 частей
серы…………………………10 частей
трехсернистой сурьмы…………..3 части
негашеной извести……………..4 части
Красный огонь:
пороховой мякоти………………1 часть
серного цвета………………….1 часть
азотнокислого стронция…………13 частей
Эти два состава совершенно безопасны, а в большинство других входит бертолетова соль. Состав из 4 частей бертолетовой соли и 1 части серного цвета может служить основой для всевозможных огней.
Очень красивый пурпурный огонь дает смесь:
указанного состава……………..8 частей
чистого мела в порошке………….2–3 части
Очень ярким огнем горит состав:
бертолетовой соли………………4 части
серного цвета………………….5 частей
трехсернистой сурьмы…………..2 части
угля (тончайший порошок)………1 часть
азотнокислого стронция…………20 частей
Зеленый огонь:
бертолетовой соли………………5 частей
серного цвета………………….4 части
азотнокислого бария…………….12 частей
Бертолетову соль из этого состава можно выкинуть, но тогда азотнокислый барий надо заменить хлорноватокислым:
хлорноватокислого бария. . . 3 части
серного цвета. . . . . . 1 часть
Этот состав воспламеняется очень легко сам собою, поэтому будьте осторожны и не заготовляйте его слишком много. Менее опасен, но не так красиво горит следующий состав:
хлорноватокислого бария. . . 3 части
молочного сахара. . . . . 1 часть
Общее правило для сжигания этих огней — не насыпать их кучкой: они образуют шлак, который гасит и затемняет их. Сыпьте узенькой дорожкой на составленные концами кирпичи, камни или черепицы.
Для свечей употребляют другие составы.
Белый огонь:
селитры………………………4 части
серного цвета………………….2 части
Красный огонь:
бертолетовой соли………………8 частей
азотнокислого стронция…………12 частей
стеарина (скобленого)…………..2 части
молочного сахара………………1 часть
Зеленый огонь:
бертолетовой соли………………2 части
азотнокислого бария…………….1 часть
молочного сахара………………1 часть
При изготовлении свечей очень большое значение имеют качество гильз и способ их набивки. Гильза должна сгорать вместе с составом, поэтому ее делают не из картона, а из бумаги, скатывая в несколько слоев.
Набивать свечи надо туго, тогда они горят ярко и ровно. Только помните, что многие составы взрываются, поэтому всегда набивайте гильзу деревянной лопаточкой; при этом смочите состав водой. Хорошо высохнув, он будет гореть даже дольше, чем набитый сухим.
Гильза скатывается на палочке диаметром около 3 сантиметров. Перед тем как снять ее с палочки, один конец немного сдвигается и стягивается бечевкой. Когда набьете всю гильзу, также затяните бечевкой и другой конец.
Чтобы свечи, огни и всякие другие фейерверки хорошо выходили, надо напрактиковаться.
Образование кристаллов. Газообразное, жидкое или твердое состояние тел зависит от температуры и от давления, под которым тела находятся.
Большое влияние на состояние тел оказывает температура, и вы, конечно, знаете влияние температуры на самое распространенное на земном шаре вещество — воду.
Если поставить охлаждаться жидкость в совершенно спокойном состоянии, можно проследить результаты понижения температуры.
Удивительно тонко и точно работает мороз, преображая частицы воды, содержащиеся в воздухе. Вдруг на каком-нибудь месте стекла на нашем окне появляется едва заметная игла. Она растет и утолщается. Затем появляются вторая, третья, четвертая… Они толкают друг друга и соединяются в симметричные группы. Они украшают друг друга так нежно и тонко, что глаз никогда не устает следить за этой работой. Кристаллизация продолжается, все новые и новые кристаллы заполняют свободное пространство.
Примерно то же самое повторяется при образовании твердых тел из растворов. При этом кристаллизация видна даже лучше.
Все вещества кристаллизуются по-своему, каждое имеет свою особую, только ему присущую форму кристалла, частицы сами сцепляются и вырастают, образуя твердое тело.
Чтобы проникнуть в тайну кристаллизации, прибегали к сильнейшим микроскопам, проникали при помощи их в глубину кристаллов при их формировании, прибегали к помощи фотографии, но до сих пор безуспешно, потому что едва появляется первый след ничтожнейшего кристаллика, как он оказывается уже вполне сформированным, со всеми поверхностями и гранями настоящего кристалла.
Если вы хотите заняться наблюдением над кристаллизацией, вы можете на первый раз проделать очень простой опыт.
Налейте в большую банку теплой воды и всыпьте в нее полную горсть медного купороса. Если весь купорос растворится, подсыпьте еще и проделывайте это до тех пор, пока на дне не останутся нерастворившиеся кристаллы. Этот насыщенный раствор является таковым только для известной температуры. Нагрейте его — и все кристаллы растворятся. Остудите раствор до температуры ниже той, при которой вы его насыщали, и на дне сейчас же появится большое количество кристаллов. Значит, для образования кристаллов всякий раствор должен быть охлажден до температуры ниже той, при которой он насыщался.
Наблюдая за кристаллизацией, можно заметить несколько случаев:
1. После охлаждения до комнатной температуры в растворе не образуется кристаллов. Это значит, что он не был насыщенным.
2. Медленно появляются хорошо сформированные кристаллы при комнатной температуре раствора. Это значит, что раствор был вполне насыщен.
3. При первом же незначительном понижении температуры образуются кристаллы и быстро громоздятся в беспорядочную кучу. Это значит, что раствор был насыщен при высокой температуре.
Теперь вы знаете, что надо делать, чтобы вызвать кристаллизацию. Но если вы хотите получить отдельные хорошие кристаллы или группы кристаллов, надо предпринять еще кое-что.
Растворите побольше квасцов в теплой воде. Квасцы хорошо растворяются и быстро кристаллизуются. Из насыщенного раствора вы уже на другой день получите хорошие кристаллы. Слейте с них раствор и отставьте его куда-нибудь в теплое место. По мере того как из него будет испаряться вода, он все время будет кристаллизоваться.
Из первых кристаллов выберите лучшие и опустите их в отставленный раствор; они мало-помалу вырастут в прекрасные кристаллы правильной формы. Их нужно только изредка поворачивать в разные стороны.
Хромовые квасцы тоже дают чудные кристаллы темно-красного цвета. Получить их можно точно таким же способом.
Можно небольшой кристалл хромовых квасцов опустить в раствор простых квасцов; он будет продолжать расти, и получится наконец красный кристалл внутри и прозрачный снаружи.
Очень хорошо кристаллизуются щавелевокислый аммоний, сода, селитра, двухромовокислый калий и медный купорос. Только ни один из них не дает таких чудных кристаллов, как квасцы.
Интересно, что кристаллы, как и капельки влаги в воздухе, ищут, на чем бы им осесть. Неровные, шероховатые поверхности лучше всего способствуют образованию кристаллов. В этом легко убедиться, если в насыщенный раствор опустить шерстяную нитку и стеклянную трубку. Нитка быстро начнет покрываться кристаллами, а трубка так и останется чистой.
Светящаяся кристаллизация. Некоторые вещества при кристаллизации светятся. Но они очень ядовиты, и для нашего опыта можно воспользоваться только сернокислым калием. Сернокислый калий и поташ, которые нужны нам для этого опыта, должны быть совершенно чистыми.
Оба вещества растворите отдельно в больших количествах воды. Профильтруйте раствор поташа и осторожно влейте в него раствор калия, постепенно размешивая. Вливайте его до тех пор, пока не прекратится шипение.
Получившуюся смесь профильтруйте и кипятите ее до тех пор, пока на стеклянной палочке, смоченной раствором, при охлаждении не покажутся кристаллы. Тогда дайте всему раствору медленно охладиться в большом тазу, и вы увидите при кристаллизации яркие искорки, особенно хорошо видимые в темноте.
Как заставить карандаш висеть на пепле сгоревшей нитки. Отрежьте кусок нитки длиной сантиметров двадцать пять и подвесьте на ней легкий маленький карандашик из записной книжки или другой какой-нибудь предмет приблизительно такого же веса. Затем попросите кого-нибудь из присутствующих поджечь нитку, а вы заранее скажите, что карандаш останется висеть на пепле. Большинство, понятно, отнесется к такому фокусу с недоверием. Но вашу нитку можно спокойно зажечь, и получится великолепный результат. Нитка сгорит бесцветным пламенем, а предмет останется висеть на пепле.
Такой фокус показать нетрудно. Нужно предварительно опустить нитку в крепкий раствор квасцов. Высохнув, она покроется корой маленьких кристалликов. Во время сгорания нитки квасцы сплавятся и сцепят частицы пепла.
Для большего эффекта вы можете пропитать квасцами не конец нитки на катушке, а отступя, скажем, метр, и тогда, если кто-нибудь попробует проделать этот опыт, у него карандаш обязательно упадет, а вы, нащупав, откуда начинается пропитанная квасцами нитка, отрежете ее и блестяще проделаете опыт.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Глава шестая РАБОТА ИЗМЕНЯЕТ МАССУ
Глава шестая РАБОТА ИЗМЕНЯЕТ МАССУ Масса Допустим, что мы хотим заставить двигаться с определенной скоростью какое-нибудь покоящееся тело. Для этого мы должны приложить к нему силу. Тогда, если движению не препятствуют посторонние силы, вроде силы трения, тело придет в
Глава шестая. Становление советской физики
Глава шестая. Становление советской физики Исторические замечания В истории науки перевороты в развитии науки нередко происходили одновременно с социальными переворотами. Вряд ли это совпадение можно считать случайностью. Наука — социальное явление, и изменение
Проблемы химии
Проблемы химии Как состав молекулы определяет ее облик?Знание орбитального строения атомов в простых молекулах позволяет довольно легко определить внешний вид молекулы. Однако теоретические исследования облика сложных молекул, особенно биологически важных, пока не
Глава первая Опыты по механике
Глава первая Опыты по механике Рубль на листке бумаги. Положите на край стола открытку так, чтобы две трети ее выступали, а на открытку у самого края поставьте на ребро серебряный рубль или пятак (рис. 1). Конечно, это место стола не должно быть покрыто скатертью, и стол
Глава вторая Опыты со звуком
Глава вторая Опыты со звуком Некоторые сведения о звуке. Наше ухо — удивительно тонкий инструмент, воспринимающий звуковые явления. Каждое вызванное хотя бы легким толчком воздуха колебание тонкой кожицы, так называемой барабанной перепонки, туго натянутой в ухе,
Глава третья Опыты с теплотой
Глава третья Опыты с теплотой Самое наглядное свойство теплоты заключается в способности вызывать расширение всяких тел — твердых, жидких и газообразных. Но твердые и жидкие тела, взятые в одинаковых объемах, при одинаковом повышении температуры расширяются одни
Глава четвертая Опыты со светом
Глава четвертая Опыты со светом Солнечные часы. Попробуйте проследить за своей тенью на открытом воздухе в различные часы дня и разные времена года. Тень не остается неподвижной, она как будто ползет вокруг нас. Утром она падает по направлению к западу, в полдень — к
Глава шестая «Проклятые» вопросы
Глава шестая «Проклятые» вопросы Если Брама, Зороастр, Пифагор, Фалес, кроме многого множества других греков, французов и немцев, строили свои системы, то почему же и мне таковую не построить? Каждый имеет право разгадывать
Шестая глава ДНК теории струн
Шестая глава ДНК теории струн При поиске алмазов, если вам повезет, вы также можете найти и другие драгоценные камни. Когда я заявил о своем доказательстве гипотезы Калаби в 1977 году в своей двухстраничной статье, за которой последовало само доказательство на семидесяти
Глава шестая Свет и глаз
Глава шестая Свет и глаз Страшная тень – Хочешь увидеть нечто необычайное? – как-то вечером обратился ко мне в детстве старший брат. – Пойдем со мной в соседнюю комнату.Комната была темная. Брат взял свечу, и мы пошли. Отважно шагал я впереди, смело открыл дверь и храбро
Глава седьмая Электрические опыты
Глава седьмая Электрические опыты Наэлектризованный гребень Если вы еще даже ничего не знаете из науки об электричестве, не знакомы даже с первыми буквами ее азбуки, вы и в таком случае можете проделать ряд электрических опытов, любопытных и во всяком случае полезных
ГЛАВА ШЕСТАЯ,
ГЛАВА ШЕСТАЯ, в которой рассказывается о больших и малых черных дырах, о космических просторах внутри электрона, о крупинках вещества, каждая из которых — целая вселенная. Вместе с автором читатель приходит к выводу, что противопоставлять микромир космосу можно далеко