ЭЛЕКТРОЛИЗ
ЭЛЕКТРОЛИЗ
Благодаря батарейке Вольты химики открыли, что электрический ток протекает вдоль контура по кабелю, идущему от одного полюса батарейки к другому. При этом если кабели на концах контура присоединить к металлическим электродам, погруженным в жидкость, ток пройдет по ней и начнется химический процесс расщепления.
Возьмем в качестве примера такой жидкости воду (H2O). В результате ее расщепления у одного из электродов появится водород, а около другого — кислород. Если над электродами расположить сосуды соответствующего вида, можно будет собрать данные газы по отдельности.
Через три десятилетия после первого опыта по расщеплению воды электричеством Фарадей использовал термин «электролиз». Исследования этого явления сделали очевидной возможность обратной реализации знаменитого эксперимента Генри Кавендиша (1731–1810), осуществленного в 1784 году: он получал воду, пропуская искру через сосуд с водородом и кислородом.
Первая «электролизация» воды была осуществлена английским химиком Уильямом Николсоном (1753–1815) через некоторое время после изобретения батарейки Вольты, 20 марта 1800 года. С помощью своего коллеги Энтони Карлайла(1768–1840) Николсон создал первую в Англии копию батарейки. Для улучшения электрического соединения он погрузил электроды от батарейки в сосуд с водой, и у каждого из электродов были собраны водород и кислород. Опыты по собиранию газов у электродов стали широко распространенными. Первым, кто увидел, что объем полученного в ходе электролиза водорода вдвое превышает объем кислорода, стал Гемфри Дэви. Пропорциональное распределение — две части водорода на одну часть кислорода — заставляло думать, что в воде больше атомов водорода, чем кислорода, и что каждая частица воды состоит из трех атомов, а не двух, как предлагал Джон Дальтон (1766–1844):
«Почему не допустить, что вода принимает одинаковый объем каждого из газов? Я долго размышлял над этим вопросом и, хотя меня полностью не удовлетворяет ответ, почти убежден, что данное обстоятельство зависит от веса и количества последних частиц, составляющих разные газы».
То есть химическая комбинация состоит из взаимодействующих атомов определенного и характерного веса. Данное заключение об атомном составе было, в конце концов, сформулировано Жозефом Луи Гей-Люссаком (1778–1850).
* * *
Электрический разряд как фактор химических реакций
До того как Фарадей начал свои исследования, считалось, что бывают разные виды электричества, в зависимости от источника. В начале XIX века думали, что существуют два вида электричества, изначально названных «стеклянное» и «смоляное», то есть положительное и отрицательное соответственно. Эта концепция, введенная Шарлем Франсуа де Систерне Дюфе, позволяла разделять все тела с точки зрения электричества: те, которые при натирании ведут себя как стекло, то есть электрически положительные, и те, которые при натирании ведут себя как смола, — электрически отрицательные (положительные и отрицательные — термины, введенные Бенджамином Франклином). Химические реакции можно было объяснять с позиции электрического притяжения и отталкивания. Таким образом, полюса контура притягивали на расстоянии компоненты молекулы, в конце концов разрушая ее.
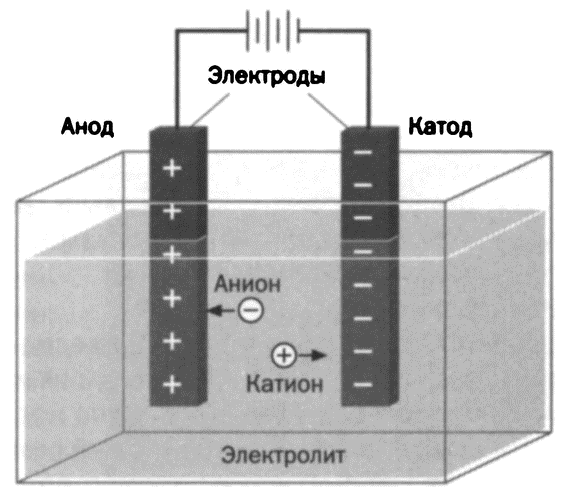
Необходимость электрического разряда
Майкл Фарадей экспериментально доказал, что самой по себе близости двух электрических полюсов недостаточно для химической реакции: нужен электрический разряд. Эксперимент состоял в том, чтобы поместить бумагу, смоченную раствором йодистого калия, между двумя заряженными электродами. При высвобождении йода бумага окрашивалась в характерный фиолетовый цвет, и таким образом становилось очевидно, что произошла химическая реакция. Тогда ученый смог наблюдать, что близости электродов недостаточно.
Чтобы йод высвободился, а бумага окрасилась, нужен был электрический разряд. Для интерпретации данного явления Фарадей предложил, чтобы электрический ток вызывал помехи в химическом растворе, — это приводило к высвобождению йода.
Фарадей. мастер новых терминов
С помощью советов Уильяма Уэвелла (1794–1866), специалиста по классическим языкам и исследователя Тринити-колледжа Кембриджского университета, Фарадей придумал множество неологизмов для обозначения явлений и понятий в своих теориях и изобретениях. Для того чтобы новый термин был как можно более точным, Фарадей описывал Уэвеллу понятие или ситуацию со своим характерным умением использовать прозу там, где другие прибегали к математическим уравнениям, а Уэвелл, который, как считается, ввел термин «ученый» (заменяющий слово «натурфилософ»), предлагал свой вариант неологизма.
Электрохимия
Особенно интересны термины, введенные для понятий, связанных с электрохимией. Если в своих предыдущих исследованиях Фарадей был пионером и ему требовались абсолютно новые термины, то в области электрохимии уже существовал некоторый понятийный аппарат. Однако Фарадей считал, что старые термины не соответствуют тому, что обозначают: он был уверен в неотложной необходимости ввести новые термины для описания знакомых понятий, чтобы не ограничивать процесс осмысления старыми рамками. Например, для терминов «анод» и «катод» Фарадей представил Уэвеллу образ тока, перемещающегося в направлении восток — запад. Этот образ тесно связывался с земным магнетизмом и линиями широты.
Уэвелл предложил два варианта: эйсод (путь входа) и эксод (путь исхода), или анод (путь с востока) и катод (путь на запад). Фарадей в конце концов
выбрал второй вариант, так как он лучше описывал то, что ему хотелось выразить. Также совместно они придумали термин «электролиз», то есть разложение молекул электрическим током. Им принадлежит термин «ион» (идущий) — заряженная частица, движущаяся в растворе. В свою очередь, ионы, движущиеся к аноду, стали анионами, а те, что перемещаются в направлении катода, — катионами. Уэвелл придумал и много других терминов, связанных с наукой. Одно из таких обозначений не имеет эквивалента в русском языке — это все чаще произносимый в последнее время термин consilience, его ввел в моду Эдвард О. Уилсон в книге, озаглавленной «Consilience. Единица знания», и он означает определенный подход к обобщенному изучению науки и гуманитарных дисциплин, выведение общего из разных классов знания.

Уильям Уэвелл.
* * *
Но именно Майкл Фарадей назвал электродами две металлические пластины, погруженные в жидкость для электролиза. Отрицательный электрод получил наименование «катод», а положительный — «анод». Атомы, как правило, нейтральны, у них нет положительного или отрицательного заряда, но прохождение тока через жидкость делало атомы заряженными и заставляло их перемещаться. Фарадей назвал заряженные атомы ионами. Сегодня нам известно, что ион является заряженным атомом, потому что он получил или потерял электроны, но Фарадей в ту эпоху не мог знать об электронах, хотя, несомненно, у него были определенные догадки на этот счет.
Электрохимические эксперименты в этой области показали, что существует два основных класса химических элементов: те, что, распадаясь при электролизе, перемещаются к положительному полюсу электрической цепи (электроотрицательные элементы), и те, которые перемещаются к отрицательному полюсу (электроположительные элементы).
Были сделаны попытки встроить в эту зарождающуюся органическую химию теорию, разработанную Гемфри Дэви и шведским химиком Берцелиусом (1779–1848), согласно которой электрическое взаимодействие между электроположительными и электроотрицательными элементами должно было полностью или частично нейтрализовываться, а с помощью остаточного заряда могли формироваться новые, более сложные соединения с более хрупкими связями.
Тогда были открыты свободные радикалы — группы атомов, которые в химических реакциях ведут себя как отдельная единица и способны соединяться, что парадоксально, как с электроположительными, так и с электроотрицательными элементами. Таким образом, свободные радикалы ставили под сомнение предсказания дуалистской теории и представляли органическую химию как намного более сложную дисциплину, чем казалось на первый взгляд.
* * *
Электролиз воды
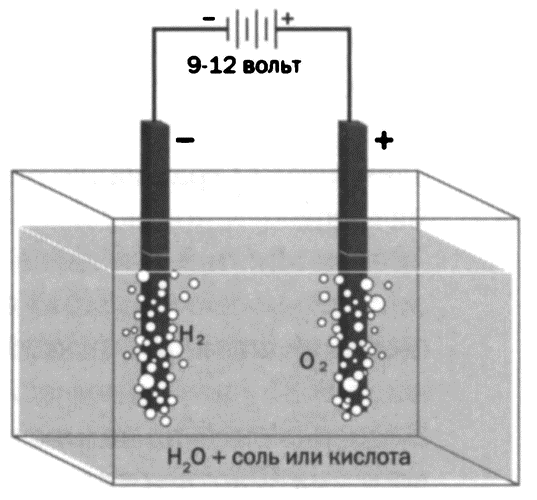
Электролиз воды — это разложение воды (H2O) на газы — кислород (O2) и водород (H2) — с помощью пропускания электрического тока через воду. Этот процесс позволяет подтвердить соотношение, в котором находятся эти два газа: 2 объема водорода на 1 объем кислорода. Отрицательно заряженный катод собирает катионы водорода для формирования газа водорода. Положительно заряженный анод направляет электроны к аноду для замыкания цепи. Чистая вода не проводит электричество. Для осуществления реакции в воду добавляется несколько капель серной кислоты (Н2SO4), электроды должны быть из платины, используется постоянный ток. в результате мы получаем вдвое больший объем H2 (на катоде) по сравнению с O2 (на аноде). Более детально рассматривая процесс, мы можем наблюдать, что при погружении двух электродов в кювету с водным раствором (вода и несколько капель серной кислоты) в растворе будут находиться ионы водорода (Н+) и сульфата (SO4-). Если затем подключить генератор электрического тока, некоторые молекулы воды будут распадаться на H+ и ОН-. В результате ион OH- будет образовывать воду и молекулы газа кислорода, осаждающиеся на аноде в виде пузырьков.
При этом ион SO4- вернется в раствор и останется в состоянии иона. В то же время ионы H+ от кислоты и воды уступят свои заряды и образуют молекулы водорода, осаждающиеся в виде пузырьков на катоде.
* * *
Открытие свободных радикалов привело к необходимости выявить число возможных комбинаций, которые могли создавать каждый радикал и каждый элемент. Позже это число назовут валентностью. Таким образом, давалась численная оценка способности одного или нескольких атомов элемента заменять один или несколько атомов другого элемента в сложной органической структуре.
Результаты экспериментов, проведенных Фарадеем в области электрохимии, можно обобщить в двух предложениях, которые получили название «законы электролиза Фарадея».
— Масса химических веществ, осажденных на электроде, прямо пропорциональна количеству пропущенного тока на требующееся для процесса время.
— Для данного количества электричества масса освобожденных химических элементов прямо пропорциональна их химическим эквивалентам.
Химическим эквивалентом, или эквивалентной массой, называется масса элемента, взаимодействующая с примерно 1 граммом водорода. Необходимое количество электричества для осаждения химического эквивалента любого постоянного элемента является константой, названной постоянной Фарадея, равной 96500 Кл, что эквивалентно 1 фараду (Ф). Таким образом, математическая формула, объединяющая оба закона, выглядит так:
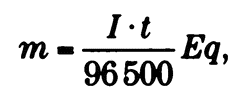
где т — масса в граммах осажденного на электроде элемента, I — сила тока, t — время прохождения тока через раствор, Eq — химический эквивалент элемента.
Современная электрохимия появилась благодаря законам электролиза, сформулированным Фарадеем. В связи с этим в его честь фарадом (Ф) называется единица, используемая в электрохимических системах для расчета массы элементов, которые осаждаются на электроде, то есть количество электричества, необходимое для осаждения химического эквивалента элемента: 23 грамма натрия, 108 граммов серебра или 32 грамма меди.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК