Тяжелый карлик
1911 год
«Эрнест Резерфорд... произвел величайшую перемену в нашем взгляде на материю со времен Демокрита».
Английский физик АРТУР ЭДДИНГТОН
Что волновало ученых?
Наступление на атом продолжалось с новой силой.
Вспомним «пудинг с изюмом» — модель атома, которую создал Томсон в 1903 г. Ведь он предположил, что атом представляет собой сферу, равномерно заряженную положительным электричеством, в которую вкраплены отрицательно заряженные электроны. Сумма всех положительных зарядов равна сумме отрицательных. В целом атом нейтрален.
Но многое было неясно в этой модели.
Что представляет собой положительно заряженная масса атома?
Как связать между собой модель атома Томсона и наблюдаемые явления испускания из атома бета-частиц, т. е. электронов, положительно заряженных альфа-частиц и гамма-лучей, не имеющих заряда?
Есть ли в атоме положительно заряженные частицы?
Наконец, правильна ли модель атома, созданная Томсоном?
Ведь он создал модель на основе предположений. А их надо подтвердить опытом.
Все эти вопросы волновали ученых. И постепенно атом раскрыл свои тайны. Особенно много сделал в этом отношении знаменитый английский ученый Эрнест Резерфорд.
Важнейшая дата
1911 год вошел в биографию атома, как год создания новой модели атома, модели, положившей начало современному представлению об атоме. И эта модель ничего общего не имела с моделью «пудинг с изюмом» Томсона. Ее создал Резерфорд, ученик Томсона.
Доказательства правильности новой модели были неопровержимыми. И модель атома Томсона постепенно была отвергнута учеными. На смену ей пришла модель атома Резерфорда, о которой мы и хотим рассказать.
Студент делает важное предположение
Рассказывая биографию атома, мы уже несколько раз упоминали о Резерфорде. Это он впервые сделал предположение, что радиоактивность — внутриатомный процесс, а в 1899 г. обнаружил в составе излучения, испускаемого ураном, два сорта лучей: альфа- и бета-лучи. Это он в 1900 г. установил, что альфа-лучи представляют собой поток атомов гелия и что радий непрерывно превращается в другой элемент—радон.
Но еще значительно раньше (в 1891 г.), когда Резерфорд только учился в Кембриджском университете, на заседании студенческого научного общества он выступил с одним докладом. Название доклада для того времени звучало очень странно: «Эволюция элементов». В этом докладе Резерфорд высказал мысль, что все атомы состоят из одинаковых элементарных частиц. Такая мысль для того времени была очень необычной. Ведь господствовавшая тогда теория Дальтона говорила о том, что атомы элементарны, т. е. неделимы. Поэтому никто и не обратил внимания на высказывание какого-то студента. Но это было прозорливое высказывание. Потом оно блестяще подтвердилось, когда Томсон открыл электрон и разработал первую модель атома, в состав которого входили электроны.
Незадачливый преподаватель
После окончания Кембриджского университета Резерфорд поступил преподавателем в среднюю школу. Но эта деятельность для Резерфорда оказалась неудачной: ему мешало увлечение физикой.
Преподаватели школы, в которой работал Резерфорд, проходя по коридору, не раз обращали внимание на шум в классе, где вел урок Резерфорд. И среди этого шума выделялся громкий голос учителя, который с увлечением рассказывал о новых открытиях в физике, не обращая никакого внимания на шум в классе. Когда преподаватели прислушивались к тому, что говорил учитель, им казалось, что Резерфорд читает лекцию не ученикам школы, а по крайней мере научным работникам. В ней было столько непонятных терминов и объяснений, что не только ученикам, но и преподавателям было неясно содержание лекции. Резерфорд слишком увлекался и забывал о подготовке своих слушателей. Поэтому ученики и шумели.
Однажды в дом к Резерфорду пришло письмо. В нем сообщалось, что ему, как лучшему бывшему студенту университета, присвоена премия. Эта премия давала возможность продолжить образование в лучших английских университетах. Мать немедленно сказала об этом сыну, копавшему картошку на огороде. Резерфорд бросил лопату и воскликнул: «Это последняя картошка, которую я выкапываю». Он ни минуты не раздумывал. Решение пришло сразу: в Кембриджский университет, к известному физику Джозефу Томсону.
Ученик опровергает учителя
Начались годы работы под руководством Томсона. Учитель сразу обратил внимание на своего талантливого ученика.
Вначале Резерфорд занимался исследованиями в области радио. Впоследствии Томсон даже сказал, что он чувствовал себя виноватым, когда посоветовал Резерфорду заняться изучением беккерелевых лучей. Ведь успехи Резерфорда в области радиотелеграфии были очень велики.
Учитель и ученик начали наступление на атом. Последовал ряд блестящих открытий Резерфорда, о которых мы уже рассказали. Наступил 1911 год. В этом году Резерфорд произвел исключительный по своему значению эксперимент, доказавший существование ядра атома.
Эксперимент заключался в следующем. Резерфорд изучал рассеяние альфа-частиц при прохождении их через очень тонкие металлические пластинки. К своему большому удивлению, он заметил, что некоторые альфа-частицы при прохождении пластинки резко изменяли свой путь. Более того, некоторые даже отскакивали назад. Было ясно, что альфа-частицы сталкивались с атомами вещества пластинки. Но почему они при этом резко изменяли направление своего полета? Ведь согласно модели Томсона атом представляет собой сферу с равномерно распределенными положительными зарядами и вкрапленными в сферу электронами.
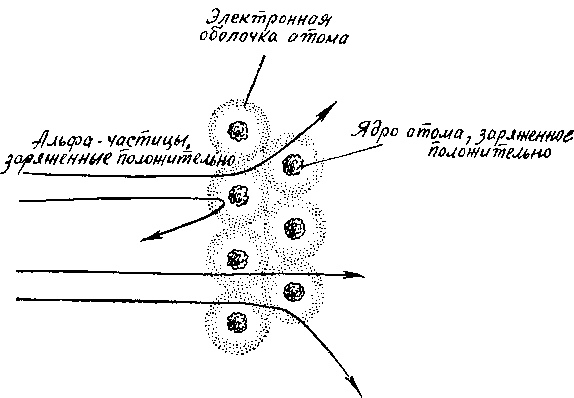
Схема опыта Резерфорда по пропусканию альфа-частиц через очень тонкие металлические пластинки. Этот опыт показал, что атом имеет ядро, заряженное положительно, и, следовательно, отрицательные заряды атома располагаются отдельно от положительных на электронных оболочках. А в целом атом нейтрален.
В целом он нейтрален. И такую сферу альфа-частицы, несущиеся с огромной скоростью, должны были бы пробивать, по выражению Резерфорда, «как пуля бумагу».
Но они не пробивали сферу. Над этим непонятным явлением долго ломал голову Резерфорд. И наконец пришел к чрезвычайно важному выводу. Раз положительно заряженные частицы резко изменяют свой путь и даже отскакивают назад, значит, они наталкиваются на какую-то положительно заряженную преграду: ведь одноименные заряды отталкиваются. Такой преградой мог быть только атом. Но это опровергает модель Томсона, согласно которой атом в целом нейтрален. Значит, решает Резерфорд, модель атома Томсона неправильна! Весь положительный заряд атома сосредоточен в его центре, отдельно от отрицательно заряженных электронов. Только в таком случае для альфа-частиц он может служить преградой.
Так ученик опроверг своего учителя.
Планетарная модель
Продолжая исследования, Резерфорд постепенно создал свою знаменитую планетарную модель атома.
Согласно этой модели, весь положительный заряд атома сосредоточен в его центре—ядре. А отрицательно заряженные электроны вращаются по своим орбитам вокруг этого
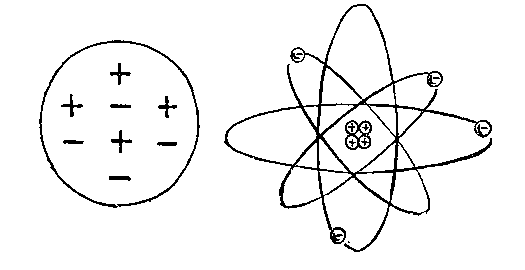
Слева — модель атома, созданная Томсоном. Положительные и отрицательные заряды распределены равномерно. Справа — модель атома, созданная Резерфордом. Положительные заряды атома сосредоточены в центре ядра атома.
ядра. Примерно так же, как планеты вокруг Солнца. Отсюда и произошло название — планетарная модель.
При этом, как установил Резерфорд, ядро в 10 000 раз меньше всего атома. Заряд ядра уравновешивается зарядами вращающихся вокруг ядра электронов, которые находятся в так называемой электронной оболочке. Поэтому в целом атом нейтрален. Сколько электронов, столько и положительных зарядов в ядре.
Загадка положительных зарядов
Действительно, что это за таинственные положительные заряды в ядре? Об этом и спросил себя Резерфорд после
создания своей планетарной модели атома. И он решил разгадать эту загадку. Бомбардируя электронами атомы водорода, ученый обнаружил, что нейтральные атомы водорода превратились в положительно заряженные. Но было известно, что атомы водорода имеют один электрон и один положительный заряд в центре. Значит, решил Резерфорд, этот один положительный заряд и является ядром атома водорода. Он назвал частицу, несущую положительный заряд, протоном.
Это произошло в 1914 г., через три года после создания планетарной модели и спустя 17 лет после открытия Томсоном первой элементарной частицы, входящей в состав атома. Теперь их стало две — электрон и протон.


Учитель и ученик: Томсон (слева) и Резерфорд,
Тяжелый карлик
Когда Резерфорд определил массу протона, то оказалось, что он неимоверно «тяжел». Разумеется, по отношению к другой элементарной частице — электрону. Масса протона примерно в 1840 раз больше массы электрона. В то же время заряды у них равны. Отрицательный заряд маленького электрона полностью нейтрализует положительный заряд протона.


Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Какой металл самый тяжелый?
Какой металл самый тяжелый? В обиходе свинец считается тяжелым металлом. Он тяжелее цинка, олова, железа, меди, но все же его нельзя назвать самым тяжелым металлом. Ртуть, жидкий металл, тяжелее свинца; если бросить в ртуть кусок свинца, он не потонет в ней, а будет держаться