2.1 Особенности фотолюминесценции органических соединений
Люминесценция – это излучение атомами, молекулами, ионами и другими более сложными образованиями в ультрафиолетовой, видимой и инфракрасной областях электромагнитного спектра, возникающее при переходе этих частиц из возбужденного состояния в основное. Слово «люминесценция» происходит от латинского «lumen» («свет») и было впервые введено как «luminescenz» физиком и историком науки Эйльхардтом Видеманном (Eilhardt Wiedemann) в 1888 году для описания «всех тех явлений, которые обусловлены не только повышением температуры». Люминесценция – это «холодный свет», тогда как белое каление – это «горячий свет».
Люминесцирующие соединения можно разделить на три группы:
– атомарные соединения, люминесценция в которых происходит за счет переходов с возбужденных на основные атомные орбитали;
– молекулярные соединения (органические, металл-органические и координационные), где люминесценция обусловлена переходами с возбужденнных на невозбужденные молекулярные орбитали, в том числе локализованные на отдельных атомах,
– кристаллические соединения, люминесценция в которых является следствием перехода электрона из зоны проводимости в валентную зону или между возбужденными и невозбужденными дефектными уровнями.
Из-за общего механизма люминесценции, в литературе принято, говоря о люминесцентных свойствах, называть органическими и органические, и металл-органические, и координационные соединения. Мы в данной работе будем поступать также. Таким образом, в данном обзоре мы будем рассматривать особенности люминесценции органических соединений с акцентом на координационные соединения РЗЭ.
Основные типы люминесценции можно классифицировать по способу возбуждения. При взаимодействии света с веществом основными физическими процессами являются рассеяние и поглощение, в результате последнего из которых молекула переходит в возбужденное состояние.
Табл. 3 Классификация основных типов люминесценции по способу возбуждения

О возбужденном состоянии и его релаксации будем говорить в терминах молекулярных орбиталей, при этом основному состоянию соответствует состояние, при котором электроны заполняют орбитали с наинизшей энергией, а возбужденному – состояние, в котором один или несколько электронов занимают орбиталь выше по энергии. Каждому возбужденному состоянию соответствуют еще два состояния с различными суммарными спинами: синглетное, которое, согласно правилу Хунда, имеет энергию выше средней, и триплетное с меньшей энергией.
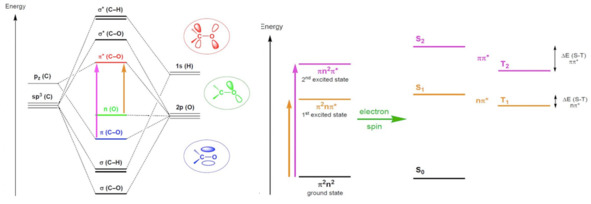
Рис. 5 Образование возбужденных состояний на примере молекулы H2CO
В случае координационных соединений MLn (M – центральный ион металла, L – лиганд) молекулярные орбитали обычно можно разделить на орбитали с преимущественным вкладом атомных орбиталей металла и молекулярных орбиталей лиганда. Возбуждение, соответствующее переходам между этими орбиталями, мы будем называть: 1) сосредоточенным на лиганде и обозначать LC (ligand-centered), 2) сосредоточенным на металле – MC (metal-centered), 3) с переносом заряда с металла на лиганд – MLCT (metal-to-ligand charge transfer) и 4) с переносом заряда с лиганда на металл – LMCT (ligand-to-metal charge transfer). В зависимости от пары металл-лиганд низшее возбужденное состояние будет соответствовать одному из этих типов. Так, в комплексах цинка с сопряженными органическими лигандами энергия орбиталей металла слишком высока, и возбуждение сосредоточено на лиганде. В комплексах металлов платиновой группы с аммиаком, напротив, в образовании основного возбужденного состояния участвуют только орбитали металла. В комплексах металлов платиновой группы с органическими сопряженными лигандами возбуждение может происходить по типу MLCT или LMCT в зависимости от лиганда и металла. При этом важно, что разница энергий между триплетным и синглетным состояниями может изменять и упорядочение возбуждений разного типа. Так, разность энергий ?E (S-T) больше в случае «чистых» переходов (MC, LC), чем в случае переходов с переносом заряда (MLCT, LMCT), поэтому возможны ситуации, когда возбуждение определяется одним типом перехода, а последующая люминесценция (релаксация возбужденного состояния за счет излучения света) другим.
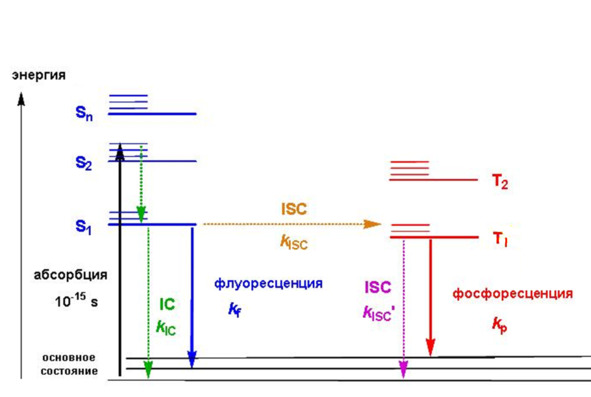
Рис. 6 Диаграмма Яблонского органических соединений. Sn – синглетные состояния, Tn – триплетные состояния; IC – внутренняя конверсия (internal conversion); ISC – внутрисистемный перенос (intersystem crossing); phosphorescence – фосфоресценция. Символами kIC, kf, kISC, kp, kISC» обозначены константы скоростей соответствующих процессов. Пунктирными стрелками обозначены процессы колебательной релаксации.
Описанные процессы можно суммировать с помощью диаграммы Яблонского, описывающей люминесценцию органических соединений. Возбуждение может происходить на любое из возбужденных синглетных состояний, после чего в большинстве случаев происходит безызлучтельная релаксация за счет внутренней конверсии (IC) в наинизшее возбужденное состояния S1
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.