5.4. Зарядовые разбалансы и валентные электроны.
Некоторые из электронов, входящие в состав внешних электронных оболочек атомов, способны участвовать в создании химических связей – такие электроны называются валентными. Так, из шести внешних электронов атома кислорода, валентными являются два, т.е. атом кислорода способен образовать не более двух стационарных химических связей. Трудно поверить, но факт: официальная наука до сих пор не объяснила, чем валентные электроны отличаются от невалентных. А ведь непонимание того, почему лишь некоторые внешние электроны способны образовывать химические связи, означает непонимание природы самой химической связи.
Сегодня понятия «валентные электроны», «валентность атома» не столь популярны, как ранее – наука зашла в тупик, так и не сформулировав правила для чёткого определения того, сколько валентных электронов имеет атом того или иного химического элемента. Валентности атомов получались не просто непостоянными – для случаев некоторых соединений они получались дробными. Сегодня специалисты, стараясь забыть про эти кошмары с валентностями, предпочитают говорить о т.н. «степенях окисления». Это понятие характеризует число электронов, которое атом может «отдать» другому атому или, наоборот, «приобрести» у него – после чего эти атомы образуют связь, якобы, благодаря кулоновскому притяжению. Но понятие «степеней окисления» не устраняет прежние трудности, а лишь приумножает их. Так, к дробным степеням окисления уже начали приучать детей [Х2].
На наш взгляд, более разумным является подход в терминах валентных электронов, причём количества валентных электронов в атомах являются, несомненно, целыми. Для устранения недоразумений с дробными валентностями необходимо допустить, что валентный электрон способен, при определённых условиях, быть связан не только с одним чужим валентным электроном, но и с несколькими – через циклические переключения химических связей (5.12). В стационарной же химической связи всегда задействованы только два валентных электрона – по одному от каждого из связанных атомов.
Отличительный признак валентных электронов, на наш взгляд, таков: валентные электроны входят в состав тех атомарных связок «протон-электрон», у которых способность продуцировать зарядовые разбалансы (5.1) задействована. Невалентные электроны входят в состав тех связок «протон-электрон», у которых скважность связующих прерываний не может изменяться – она зафиксирована на центральном, 50-процентном значении. Валентные же электроны входят в состав валентных связок «протон-электрон», у которых скважность связующих прерываний может изменяться (5.1). Именно валентная связка «протон-электрон» может иметь энергию нерезонансного возбуждения, попадающую в континуум между стационарными квантовыми уровнями. Причём, энергия нерезонансного возбуждения представляет собой энергию колебаний зарядового разбаланса, т.е. гармонических колебаний скважности связующих прерываний – с полным размахом, от 0% до 100%, и с частотой, равной частоте кванта возбуждения (5.1).
Наличие названной дополнительной степени свободы у валентных связок «протон-электрон», по сравнению с невалентными, означает, что, при пребывании атома в условиях теплового равновесия, его валентные связки значительную часть времени испытывают колебания зарядового разбаланса – с полным размахом и со спектром частот, соответствующим планковскому равновесному спектру. У валентных электронов, таким образом, связующие прерывания, с периодом ~10-16 с, испытывают более длиннопериодические осцилляции скважности, с периодом h/5kT, где h - постоянная Планка, k – постоянная Больцмана, T - абсолютная температура. При комнатной температуре этот период составляет ~3.2?10-13 с. На Рис.5.4 схематически изображена результирующая картина модуляций у электронных пульсаций протона и электрона в валентной связке.
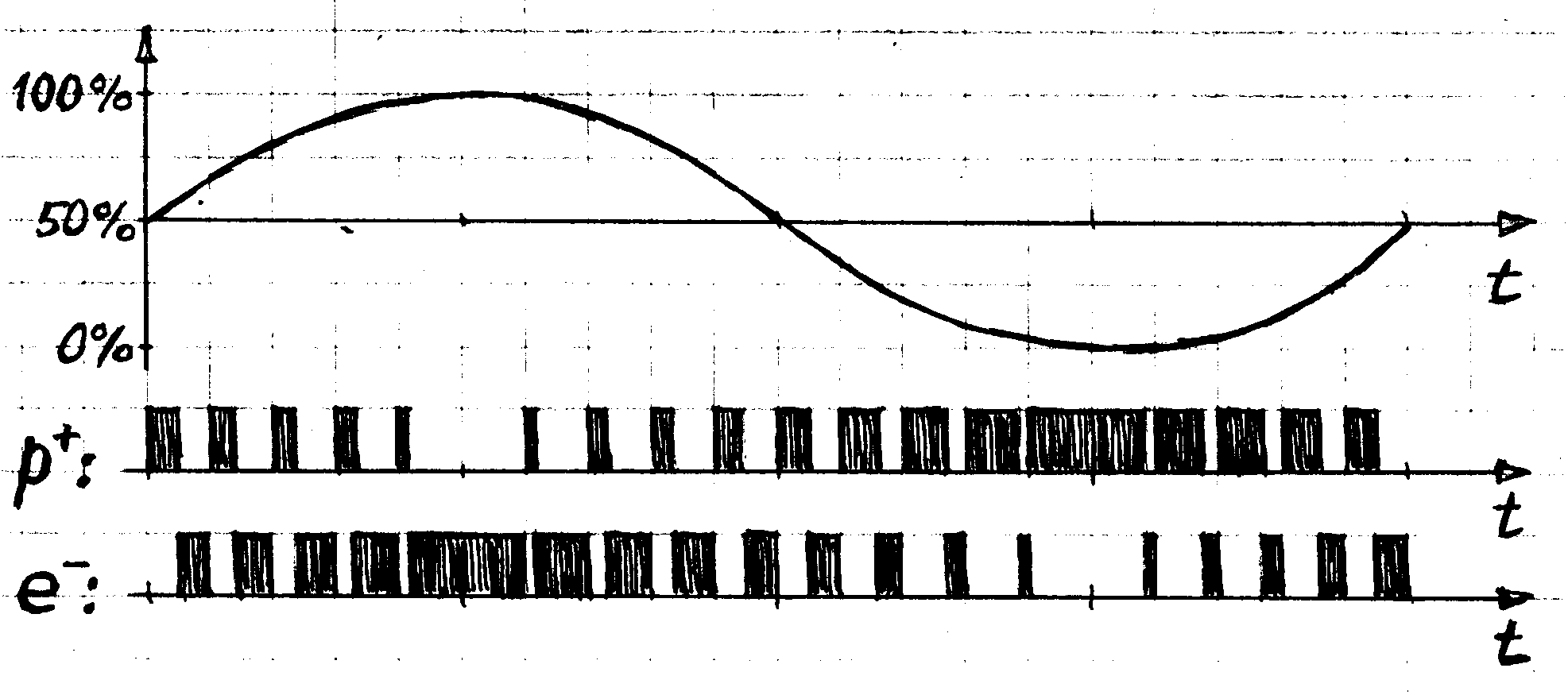
Рис.5.4 Показан один период «тепловых осцилляций» в валентной связке. Высокочастотное заполнение – электронные пульсации.
При тепловом равновесии, как можно видеть, в валентной связке «протон-электрон» происходят своеобразные «тепловые осцилляции»: при значении скважности прерываний вблизи 0%, электронные пульсации протона находятся «в тепловом бытии», а у электрона – «в тепловом небытии», а при значении скважности вблизи 100% ситуация противоположная. В отличие от частоты этих тепловых осцилляций, их фаза не является энергетической характеристикой – она может свободно перестраиваться.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК