6.2. О кислотах и основаниях
Все, что мы сейчас расскажем, в равной степени относится ко всем кислотам и основаниям — органическим и неорганическим (минеральным).
Кислоты и основания — важнейшие классы химических веществ. Они являются непременными участниками большинства химических превращений, катализаторами многих химических, биохимических и технологических процессов. Эти вещества служат источниками для получения огромного числа важных продуктов химической промышленности.
Так что же представляют собой кислоты и основания — эти, казалось бы, два антипода в мире химических веществ, два понятия, на первый взгляд исключающие друг друга?
Первым, кто сделал попытку разобраться в этом вопросе, был А. Лавуазье. Он считал, что кислоты — вещества, содержащие (обязательно!) кислород. Однако открытие в 1814 г. Гемфри Дэви (1778-1829) галогеносодержащих кислот (например, соляной кислоты) заставило пересмотреть эти взгляды и принять обратное утверждение: кислоты — это водородосодержащие соединения (Ю. Либих), в которых атомы водорода способны замещаться на металл.
Пора временного согласия наступила лишь тогда, когда химики вооружились новым учением о кислотах и основаниях (1887) — теорией шведского химика Сванте Августа Аррениуса (1859-1927)  , ставшей впоследствии классической. Согласно этой теории кислоты — это вещества, которые при диссоциации (распаде на ионы) образуют катион водорода — протон (Н+). Если же при диссоциации образуются ионы гидроксила (ОН-), то вещество будет основанием.
, ставшей впоследствии классической. Согласно этой теории кислоты — это вещества, которые при диссоциации (распаде на ионы) образуют катион водорода — протон (Н+). Если же при диссоциации образуются ионы гидроксила (ОН-), то вещество будет основанием.
Эта теория долгое время удовлетворяла химиков. Она и сейчас является верной, но при одном условии: если химики работают с водными растворами кислот и оснований. Если же они имеют дело с неводными (органическими) растворами, то теория С. Аррениуса «не работает». Дело в том, что обязательным условием кислотно-основного взаимодействия, по мнению ученого, является обратимая реакция:
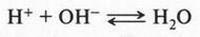
А если, например, с уксусной кислотой взаимодействует аммиак? Уксусная кислота обладает кислотными свойствами потому, что отщепляет протон. А аммиак? Почему он обладает основными свойствами? Он же не диссоциирует с образованием гидроксильного иона. В то же время хорошо известно, что такая реакция идет с образованием соли — ацетата аммония:
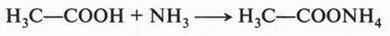
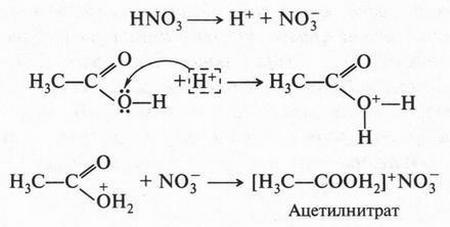
Кроме того, теория А. Аррениуса не могла объяснить, почему кислоты могут реагировать друг с другом. Например, азотная кислота, взаимодействуя с уксусной кислотой, образует ацетилнитрат:
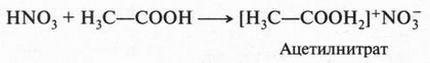
Химики-органики давно заметили, что одно и то же вещество в зависимости от характера растворителя может проявлять различные свойства. Особенно это касается органических кислот и оснований. Оказалось, что некоторые кислоты в зависимости от условий ведут себя не как кислоты, а скорее как... основания. Все зависит от того, с чем их сравнивать. Если раньше кислоты и основания рассматривали как противоположные вещества в химическом мире, то теперь возникла потребность пересмотреть эти представления. Однако для этого потребовалось свыше 30 лет.
В 1923 г. датский химик Йоханн Николаус Брёнстед (1879-1947) пришел к новому определению понятий кислоты и основания. По новой теории кислоты — это вещества, которые способны отдавать протон (доноры протонов), а основания — вещества, присоединяющие его (акцепторы протонов). Такое определение не только легко запоминается, но и способно объяснить поведение многих кислот и оснований. Например, приведенную ранее реакцию между уксусной кислотой и аммиаком можно объяснить так: уксусная кислота отдает протон, а аммиак легко его присоединяет за счет неподеленной пары электронов азота.
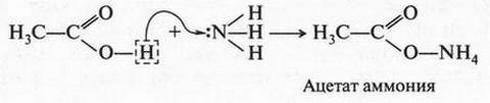
Можно теперь объяснить и вторую реакцию — взаимодействие азотной кислоты с уксусной кислотой. Азотная кислота, как более сильная, отдает протон, а уксусная кислота, как очень слабая (по сравнению с азотной), присоединяет его. Это присоединение идет за счет неподеленной пары электронов атома кислорода гидроксильной группы:
Эти примеры говорят о том, что кислоты и основания следует рассматривать в единстве, в неразрывной связи, а не противопоставлять их друг другу. Вещество может проявлять кислотные свойства лишь при взаимодействии с основанием, и, наоборот, основные свойства вещества можно обнаружить только в присутствии кислоты. Так, согласно теории С. Брёнстеда, одно и то же вещество в зависимости от условия реакции может обладать и кислотными, и основными свойствами:
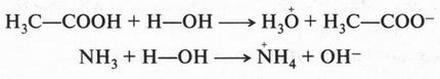
В первом случае вода проявляет свойства слабого основания (акцептор протонов), во втором — обладает слабыми кислотными свойствами (донор протонов).
Однако встречаются реакции, которые хотя и носят кислотно-основный характер, но ни одно из реагирующих веществ не является донором протонов. Примером может служить реакция окисления триметиламина.
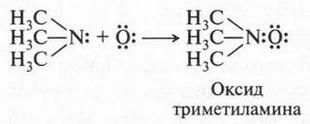
На первый взгляд трудно сказать, какое из этих веществ кислота, а какое — основание. Но это можно сделать, если принять во внимание еще одну теорию кислот и оснований, предложенную американским химиком Гильбертом Ньютоном Льюисом (1875-1946). Этот ученый предложил более широкое понятие кислоты и основания. Так, кислота, по утверждению Г. Льюиса, это соединение, неспособное к отщеплению протонов, но стремящееся использовать неподеленную пару электронов атома другой молекулы для образования химической связи. Отсюда следует и определение основания: это вещество, которое имеет неподеленную электронную пару и отдающую ее для образования этой связи. Другими словами, кислоты — акцепторы электронной пары, а основания — ее доноры. Снова рассмотрим реакцию окисления триметиламина. В этой реакции триметиламин выступает в роли донора электронной пары, а атом кислорода — в роли ее акцептора. Это означает, что триметиламин — основание, а атом кислорода — кислота.
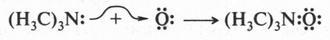
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК