ГЛАВА 1 Открытие атомного ядра
Открытие ядра атома стало незабываемым моментом в истории физики. Резерфорду оно позволило разработать новую модель атома, структурно похожую на миниатюрную планетарную систему: с протонами в ядре и электронами, вращающимися вокруг по определенным орбитам.
Крокодил. Под этим прозвищем Эрнест Резерфорд был известен всем студентам, уже будучи почтенным и уважаемым ученым. Так назвал его Петр Капица, ученик из СССР, подразумевая отеческий образ. Но в этой характеристике присутствовал и оттенок доброжелательного ехидства: крокодил неспособен поворачивать голову и смотрит только вперед, гибкость — не его черта. Резерфорд обладал сильным характером, был одержим фактами и доказательствами. Один из его боевых кличей — "Дай мне факты, и как можно скорее!" Не только студенты становились свидетелями этой непоколебимой требовательности. Известен случай, когда рабочему, нанятому для сооружения стены в лаборатории, несколько раз приходилось прерываться, так как Резерфорд кричал ему, что хочет немедленно видеть результаты его деятельности, путая беднягу с одним из исследователей.
Несомненно, страсть к получению доказательств сделала Резерфорда лучшим экспериментатором своей эпохи и одним из выдающихся ученых всех времен. Плоды скрупулезного 30-летнего труда обеспечили его вклад в науку, причем самые значительные успехи были достигнуты им уже после получения Нобелевской премии. Кроме того, он взрастил несколько поколений физиков, засиявших на звездном небосклоне позднее, но начало их пути и стимул к развитию успешной карьеры были связаны с именем Резерфорда.
ЭКСПЕРИМЕНТ РЕЗЕРФОРДА
Среди множества открытий, сделанных Резерфордом, особого внимания заслуживает обнаружение им атомного ядра. В конце 1910 года Резерфорд объявил друзьям и знакомым: "Я уже знаю, как устроены атомы". Это не было неожиданным озарением. Он почти два года обдумывал любопытное явление, отмеченное в ходе эксперимента, который должен был, по его мнению, объяснить строение атомов. "Момент эврики" наступил, когда ученый понял, что внутри атома есть образование, которое он назвал ядром. Наличие ядра предположительно было общей характеристикой для всех атомов всех элементов.
Годы спустя он завершил свою работу, обнаружив протон, положительно заряженную частицу, составляющую часть ядра. В начале XX века, когда в научном мире только-только было достигнуто некоторое согласие в отношении существования атомов, для Резерфорда стало очевидным их внутреннее строение.
Перенесемся в май 1909 года. Резерфорд недавно получил Нобелевскую премию и руководит лабораториями Манчестерского университета, одними из самых престижных в мире. В этот момент Ханс Гейгер — изобретатель счетчика радиоактивных частиц, получившего его имя, и преподаватель методов измерения радиоактивности — сообщает Резерфорду, что один его студент, по всей видимости, обладает способностями к экспериментальной деятельности. Резерфорд дает ответ: "Посмотрим, получит ли он результат при прямом отклонении альфа- частиц от металлической поверхности".
Резерфорд не возлагал больших надежд на этот эксперимент, но он был необходим, чтобы действовать методом исключения (который всегда обеспечивал ему успех). Резерфорд предложил студенту провести опыт, похожий на тот, который делал сам с момента начала работы в лаборатории в 1907 году.
Незадолго до этого Резерфорд направлял альфа-лучи на минерал, называемый слюдой, и в результате узнал, что альфа-лучи несколько отклонялись от своей траектории. Он не понимал только причину, по которой это происходило.
ВНУТРИ АТОМА
Эрнст Марсден был тем самым студентом, о котором говорил Гейгер. Данный эксперимент оказался простым, изящным и привел к находке, которая сделала его одним из самых необыкновенных опытов в истории физики.
Выяснив, как устроено ядро атомов, мы столкнулись с величайшей тайной в мире, если не считать тайны самой жизни.
Эрнест Резерфорд
Эксперимент заключался в направлении альфа-частиц, то есть частиц, возникающих в результате радиоактивных процессов и, как выяснилось позже, представляющих собой ядра гелия, на металлическую пластину в вакуумной камере.
Резерфорд и Гейгер наблюдали, что при прохождении лучей через пластину имели место случайные отклонения. Для эксперимента они выбрали пластины из золотой фольги, чтобы альфа-частицы не полностью поглощались металлом и было возможным изучить взаимодействие при прохождении через пластину.
Резерфорд не случайно остановился на альфа-частицах. Исследование радиоактивности несколькими годами ранее обеспечило ему Нобелевскую премию. Теперь альфа-частицы были для него не основным объектом интереса, а скорее инструментом для изучения внутреннего строения атомов, своеобразным ключом к пониманию составляющих материи.

РИСУНОК 1: В приведшем к открытию атомного ядра эксперименте от источника альфа-излучения исходил поток альфа-частиц, бомбардировавших золотую фольгу, которую окружал экран, флуоресцирующий под воздействием альфа-частиц.

РИСУНОК 2: Модель атома Томсона: отрицательно заряженные частицы -плавают· в положительно заряженном веществе.
За тончайшей пластиной из фольги в качестве детектора располагался экран из сульфида цинка. Характеристикой этого вещества является испускание флуоресцентного свечения при воздействии альфа-частиц. В ту эпоху наблюдать флуоресцентное свечение можно было только под микроскопом, направленным на зону воздействия частицы. Современные электронные детекторы с легкостью справляются с подсчетом всех участков воздействия, но в те времена такая работа была возможна только при прямом наблюдении и последовательном подсчете вспышек света. До начала эксперимента глаза должны были привыкнуть к темноте, поскольку при расширенных зрачках легче наблюдать вспышки. Речь идет о кропотливой и монотонной работе, однако вспышки позволяли установить место воздействия частицы на детектор-экран, а значит, проследить траекторию частиц, проникавших сквозь фольгу. Для получения альфа-частиц использовались радий или радон, два высокорадиоактивных элемента. Чтобы направить лучи в нужную сторону, их источник помещали в поглощающий излучение свинцовый сосуд с тонкой щелью, через которую лучи направлялись в вакуумную камеру на расположенную в ней фольгу (рисунок 1).
Единственной известной на тот момент субатомной частицей были электроны, обладающие отрицательным зарядом и массой, ничтожно малой по сравнению с массой атома. Так как общий заряд атома был нейтральным, Дж. Дж. Томсон, открывший электроны, предположил, что отрицательные заряды должны " плавать" в легкой положительно заряженной субстанции, некоем тумане (как если бы атом был аквариумом с рыбками-электронами и положительно заряженной водой). Данная модель атома получила название модели Томсона (рисунок 2), хотя более распространенный термин — "пудинговая модель" (пудинг, изюмом в котором стали электроны). В этой концепции обращает на себя внимание тот факт, что в ней отсутствуют другие частицы, помимо электронов.

РИС.3
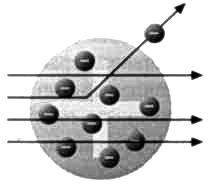
РИС. 4

РИС. 5
Согласно модели Томсона атомы состоят из частиц, электронов, -плавающих· в положительно заряженной субстанции.
При бомбардировке атомов альфа- частицами альфа- частицы должны проходить сквозь атомы беспрепятственно, не отклоняясь (рисунок 3). Однако эксперименты показали,что часть из них отклоняется (рисунок 4). Резерфорд пришел к выводу, что внутри атомов вероятно, присутствует что-то еще, не замеченное ранее.
Он предположил, что внутри атома имеется массивное положительно заряженное ядро (рисунок 5).
По логике, в описанном выше эксперименте альфа-частицы должны были проходить сквозь фольгу, практически не отклоняясь, так как согласно предположениям внутри атома не было ничего твердого, кроме электронов, значительно проигрывавших в размере альфа-частицам (см. рисунок 3), а значит, частицы должны следовать по прямой траектории к детектору-экрану. Резерфорда всегда удивляли наблюдаемые им незначительные отклонения, противоречившие модели атома Томсона. Если пудинговая модель верна, то с чем сталкивались частицы? Что изменяло их траекторию? (см. рисунок 4)
Этот досадный и неожиданный феномен всерьез увлек Резерфорда. Проведенные ранее исследования доказывали, что для изменения траектории альфа-частиц требуются тысячи вольт. Были ли связаны наблюдаемые отклонения с неточностями при реализации эксперимента или с расположением аппаратов? Возможно, речь шла о каких-то специфических свойствах элементов, участвовавших в эксперименте?
Резерфорд поставил перед Гейгером и в особенности перед Марсденом задачу создать аппарат, в котором было бы расширено поле детектора вспышек (см. рисунок 1). Ранее экран был установлен только в центральной части, так как предполагалось, что траектория будет прямой или с незначительным отклонением. Возможно ли обнаружение вспышки вне ограниченных пределов, в которых велось исследование до того момента? Техническая сложность состояла в необходимости передвигать микроскоп по всей камере для наблюдения воздействия, причем эти передвижения не должны были повлиять на вакуум внутри камеры. Марсден вместе с Гейгером пришли к изящному и эффективному решению.
Согласно расчетам, на каждый грамм радия испускалось 30 миллиардов альфа-лучей. Марсден заметил, что их огромная часть, в соответствии с высказанными предположениями, проходила сквозь фольгу без отклонений. Однако в одном из 8000 опытов имело место необъяснимое отклонение. Марсден повторял эксперимент и сосчитал тысячи вспышек воздействия, но аномалия возникала постоянно.
Более того, к общему удивлению, исследователи обнаружили, что в некоторых случаях угол отклонения был равен 90*, а иногда 180* (то есть альфа-частица отскакивала от золотой фольги и возвращалась к точке испускания). По мере того как зона наблюдения смещалась от предполагаемой зоны попадания следующих по прямой траектории альфа-частиц, процент вспышек уменьшался, но не становился нулевым. Эксперимент неоспоримо доказывал, что строение атома не такое, как было принято считать. Внутри атома, несомненно, имелось нечто "твердое", но при этом занимающее небольшое пространство в сравнении с размером самого атома, что объясняет незначительный процент отклонения лучей (см. рисунок 5). "Это было так же невероятно, как если бы 15-дюймовый снаряд ударился о лист бумаги и поразил стрелявшего человека", — такими словами Резерфорд выразил свое крайнее удивление открытием, хотя позже приписал эту фразу Гейгеру. Результаты эксперимента Марсдена и Гейгера были опубликованы в 1909 году в престижном научном издании Proceedings of the Royal Society.
ПРОБЛЕМА ИНТЕРПРЕТАЦИИ
Никто не мог интерпретировать результаты эксперимента.
А Резерфорд, имея на руках полученные данные, снова взялся за учебу. Понимая, что если он хочет распространить основанные на небольшом образце идеи об атоме на все атомы Вселенной, ему придется овладеть теорией вероятностей и математической статистикой. И несмотря на полученную Нобелевскую премию, Резерфорд не смущаясь поступил на соответствующий курс университета.
Наиболее простым является предположение, что атом имеет центральный заряд, распределенный по очень малому объему, и что большие однократные отклонения обусловлены центральным зарядом в целом, а не его составными частями.
Эрнест Резерфорд
Шаг к принятию атомного ядра и обнаружению протона — несущей электрический заряд частицы — был непростым. После статистического анализа данных об альфа-частицах, которые проходили насквозь и отклонялись, стало очевидно, что должна существовать небольшая внутренняя структура. В конце 1910 года Резерфорд объявил, что решение найдено, и 7 марта 1911 года появилась статья "Рассеивание альфа- и бета-частиц веществом и структура атома". В статье говорилось не об атомном ядре, ученый упомянул только о "центральном заряде, распределенном по малому объему", он также не решился настаивать на знаке заряда этой центральной частицы. Два года спустя в книге Radioactive Substances and Their Radiations ("Радиоактивные вещества и их излучение>) он все же ввел понятие атомного ядра и предположил, что ядро имеет положительный заряд, а отрицательно заряженные частицы вращаются вокруг него.
ОТКРЫТИЕ ЯДРА
В 1911 году Резерфорд опубликовал статью "Рассеивание альфа- и бета- частиц веществом и структура атома", в которой описал свою новую теорию атома:
"Хорошо известно, что альфа- и бета- частицы при столкновениях с атомами вещества испытывают отклонения от прямолинейного пути. [...] Поэтому нет сомнения в том, что столь быстро движущиеся частицы проникают сквозь атомы, встречающиеся на их пути, и что наблюдаемые отклонения обусловлены сильным электрическим полем, действующим внутри атомной системы. [...] Наблюдения, проведенные Гейгером и Марсденом по рассеянию альфа-лучей, показали, что некоторое количество альфа-частиц при однократном столкновении испытывают отклонение на угол, больший 90°. [...] По-видимому, разумнее предположить, что отклонения на большой угол обусловлены однократным атомным столкновением. [...] Простой расчет показывает, что в атоме должно существовать сильное электрическое поле. [...] При рассмотрении данных в целом, по-видимому, наиболее простым является предположение, что атом имеет центральный заряд, распределенный по очень малому объему. [...] При сопоставлении излагаемой в данной статье теории с экспериментальными результатами предполагалось, что атом состоит из сконцентрированного в точке центрального заряда*.

Немецкий физик Ханс Гейгер, 1928 год.
Резерфорд смог определить, что диаметр внутренней структуры в атоме должен соответствовать примерно 10-14 м, то есть быть в десять тысяч раз меньше атома. Принято сравнивать размер атомного ядра с мухой внутри огромного собора, однако в таком незначительном объеме, который представляет собой ядро, сконцентрировано 99% массы атома. Оставшееся пространство представлялось загадочно пустым и не имеющим точных пределов, лишь иногда эту пустоту пересекали электроны.
Согласно интерпретации Резерфорда частицы отскакивали друг от друга под воздействием отталкивающей силы. На тот момент было уже доказано, что частицы с одним знаком заряда отталкиваются, с противоположными знаками — притягиваются. В 1913 году этот ход рассуждений позволил Резерфорду сделать вывод, что поскольку альфа-лучи имеют положительный заряд, их отклонение при прохождении сквозь золотую фольгу обусловлено столкновением с частицами того же знака заряда. Так можно было объяснить, почему большинство альфа-частиц проходит сквозь фольгу без отклонения: им на пути не встречаются положительные заряды. Протон был обнаружен позднее, в 1918 году, когда Резерфорд понял, что открытия атомного ядра недостаточно и что нужно разделить его на составляющие и изучить его строение.
АТОМИЗМ
Открытие Резерфорда пришлось на несколько сумбурный период в истории физики. Модель атома Томсона предложена сравнительно недавно, еще не достигнуто согласие в отношении существования атомов, химики и физики почти столетие разделены на два лагеря: одни полагают, что атомизм — лишь бездоказательное пустословие, в другом лагере утверждают, что атомы — основа всех элементов. Имелось множество моделей, по-разному соотносящихся с экспериментальными данными, но результаты были неоднозначными.
Путь атомной гипотезы оказался долгим. Во все времена она становилась предметом полемики, ее сторонники обвинялись в неверии и материализме, подвергались преследованиям. Первые атомисты жили еще в Древней Греции. Демокриту (460-370 до н. э.) атомы представлялись конечными составляющими бытия, которые не могли быть разделены, разрушены, подвержены действию времени, из них образовалось все вокруг. Как считал он сам: "Лишь в общем мнении есть сладкое и горькое, теплое и холодное; в общем мнении существуют разные цвета; на самом деле существуют только атомы и пустота*.
ЭПИКУР И КЛИНАМЕН
Эпикур (341-270 до н. э.) — древнегреческий философ, родился на острове Самос. Его семья происходила из Афин, куда он перебрался позднее и где разбил сад, чтобы взращивать в нем знания и дружбу. В центр человеческой жизни Эпикур ставил удовольствие, понимание которого сближало его со скептиками. Он боролся со страхами, в том числе со страхом смерти, показывая, что в основе их всех лежат неправильные верования. Для Эпикура число атомов бесконечно (так же как и Вселенная), сами атомы вечны, неделимы и неизменны, они обладают формой, величиной и весом. Атомизм ведет к механистическому восприятию Вселенной, в которой нет места свободе воли. И, защищая свободу воли, Эпикур был вынужден включить идею о клинамене, случайном отклонении атомов. После этого можно было говорить о присутствии некоторой неопределенности во Вселенной.

Эпикур, гравюра из книги Томаса Станли "История философии-, 1655 год.
На протяжении веков атомизм был философским течением с небольшим количеством сторонников. Эпикур, например, полагал, что атомы закручиваются в вихри, создавая бесконечность "миров" со своими богами. К царству атомов относилась также и душа, состоящая из тончайших атомов. В ходе истории многие выдающиеся ученые, среди которых Галилей и Ньютон, защищали атомизм, чем способствовали развитию мысли в этой сфере. Однако отсутствовало самое главное — привязка атомизма к реальной жизни. У гипотезы не было доказательной базы, для того чтобы безоговорочно найти себе место в ряду других философских концепций. В первом издании Британской энциклопедии (между 1768 и 1771 годами) в статье "Атом" его привязка к философскому течению едва затронута: "В философии — мельчайшая частица материи, не поддающаяся делению. Атомы являются minima naturae (мельчайшими телами) и представляются началом любой физической величины".
С XIX века развитие физики и химии вынудило значительно расширить данное определение.
АТОМЫ В ХИМИИНовый этап возрождения идей атомизма в XIX веке наступил в основном благодаря химии и был обусловлен различными причинами, среди которых выделяется крушение доктрины о четырех стихиях, подчинявшей себе интерпретацию природы почти целое тысячелетие. Антуан Лавуазье (1743-1794) обнаружил, что вода, прежде считавшаяся одной из стихий, наряду с огнем, землей и воздухом, на самом деле состоит из кислорода и водорода. Это открытие дало новое понимание природы вещей на основе химической науки. Несмотря на это сам Лавуазье скептически относился к атомной теории.
Весьма вероятно, что мы никогда ничего не узнаем об атомах.
Антуан Лавуазье, французский химик
ДАЛЬТОН. ПЕРВООТКРЫВАТЕЛЬ АТОМА
Сын квакеров из Камберленда (Англия) Джон Дальтон (1766-1844) начал свою научную карьеру как метеоролог. Считается, что его представления об атоме происходят именно от исследований атмосферы. Дальтон был первым, кто обнаружил, что воздух являет собой неоднородную субстанцию и состоит в основном из азота (80%) и кислорода (примерно 20%). Он также описал дальтонизм, особенность зрения, названную его именем. Дальтон много внимания уделял преподаванию и основал академию. По поводу атомной теории в 1804 году он написал следующее:
"1. Существуют мельчайшие частицы, атомы, из которых состоит материя. 2. Атомы неделимы, их невозможно разрушить. 3. Атомы одного химического элемента имеют одинаковые химические свойства, не преобразуются и не изменяются в других элементах".
В концепции кратных отношений, предложенной Дальтоном, известной как закон Дальтона и до сих пор включенной в начальный курс химии, важен принцип сохранения массы. В любой химической реакции масса реактивов будет равна массе продуктов.

Ученым, наконец поместившим атомную теорию в центр химического знания своей эпохи, стал Джон Дальтон (1766- 1844). Он прибег к старой концепции атомизма для объяснения открытого им относительного атомного веса элементов.
Школьный учитель Дальтон в 1803 году провозгласил свой так называемый закон кратных отношений, согласно которому разные химические элементы комбинируются друг с другом, как небольшие целые числа. Закон сформулирован так:
"Если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся на одну и ту же массу другого, соотносятся между собой как небольшие целые числа".
Дальтон интерпретировал кратные отношения как доказательство атомизма. Если представить, что определенное соединение состоит из атомов разных элементов, имеющих определенную массовую пропорцию, тогда даже если мы возьмем большое количество соединений, пропорция останется неизменной. Дальтон открыл макроскопическую характеристику — постоянное отношение масс компонентов гетерогенного вещества с массами компонентов вещества — и интерпретировал ее как следствие явлений, имевших место на микроскопическом уровне, и специфическую комбинацию разных видов атомов.
В отношении атомов Дальтон настаивал, что они неделимы, что их невозможно ни создать, ни уничтожить, то есть в химических процессах происходит лишь изменение комбинаций атомов. Он выяснил, что каждый элемент состоит из атомов одного типа, схожих между собой и различающихся с атомами других элементов. Одна из отличительных характеристик, которые Дальтон установил для них, относилась к атомному весу. Он также утверждал, что атомы комбинируются при создании химических соединений.
Его убежденность в том, что атомы невозможно разрушить, привела его к отстаиванию закона о сохранении материи (ранее предложенного Лавуазье): "Мы могли бы с таким же успехом попытаться внести в Солнечную систему новую планету или уничтожить одну из уже существующих, как и создать или уничтожить частицу водорода". Тем не менее труды Резерфорда, которые мы рассмотрим в следующей главе, позволили доказать, что представление Дальтона было неполным.
СПОР
В XIX веке многие ученые полагали, что переход от макроскопического к микроскопическому миру, понимание которого основывалось на научном эксперименте, неприемлем ввиду невозможности непосредственного наблюдения микроскопического мира. Критики атомизма нашли много аргументов, отстаивая свою позицию в рамках позитивизма. Для основателя этого философского движения, французского социолога Огюста Конта (1798-1857), наука опиралась на констатацию фактов. Любое утверждение, касающееся окружающей реальности, не подпитанное фактами, расценивалось как метафизическое размышление и отвергалось наукой. С точки зрения позитивизма атомизм обладал всеми чертами метафизического пустословия.
Одним из наиболее настойчиво противостоявших атомизму ученых был Жан-Батист Дюма (1800-1884):
"Что остается от амбициозного экскурса, совершенного нами в сферу атомов? Похоже, ничего основательного. Разве только убеждение, что химия сбивается с пути всякий раз, когда оставляет дорогу эксперимента и пытается продвигаться в потемках [...]. Если бы я мог, я бы вычеркнул слово "атом" из науки, потому что убежден: это понятие выходит далеко за пределы экспериментов".
Критика атомов наталкивалась на полярное к ним отношение других химиков, например Уильяма Праута, который в 1815 году пришел к выводу, что все атомы на самом деле являются соединениями атомов водорода (что напрямую связано с доказательством Резерфорда).
Кто-нибудь когда-нибудь видел молекулу газа или атом?
Марселен Бертло (1827-1907), французский химик и историк
Появлялось все больше свидетельств существования атомов, но из-за отсутствия возможности прямой проверки ученые предпочитали отвергать гипотезу, стремясь исключить из науки чисто умозрительные измышления, к тому же многие из них считали прямую проверку чем-то выходящим за пределы человеческих возможностей.

Согласно кинетической теории газов газ состоит из атомов и молекул, находящихся в постоянном движении, сталкивающихся между собой и со стенками сосуда. При большем количестве накопленной энергии частицы двигаются быстрее, столкновений больше, а температура увеличивается.
ОЧЕРЕДЬ ЗА ФИЗИКОЙ
Острая полемика, возникшая в химической науке, распространилась и на физику. Теперь сторонники атомов включили в обсуждение термодинамику и изучение теплоты. Если в отношении теплоты еще можно отметить, что физики сконцентрировались на изучении макроскопических факторов и наблюдаемых в действительности явлений, то открытия Джеймса Клерка Максвелла и Людвига Больцмана перевернули данное представление. Оба ученых исследовали известные понятия с позиции движения атомов, при этом они не ограничились индивидуальной траекторией отдельного атома, а попытались рассчитать статистическое поведение множества атомов.
Согласно этой теории газ состоит из множества атомов, которые сталкиваются между собой и со стенками сосуда, в котором находится газ, как бильярдные шары (см. рисунок). Максвелл и Больцман установили, что средняя энергия отдельного атома газа в постоянном движении связана с давлением и температурой.
Так же как это происходило в химической науке, многие физики с недоверием относились к атомной теории. Тому имелось множество причин, среди которых, например, принцип экономии мысли. Объяснять то, что можно наблюдать, и отказываться от того, что наблюдать нельзя, многим ученым (в их числе австрийцу Эрнсту Маху) представлялось ошибкой.
В 1906 году Больцман, всю жизнь защищавший атомизм, совершил самоубийство, незадолго до того, как Резерфорд вторгся в мир атомов.
ИССЛЕДОВАТЬ ЧЕРНЫЙ ЯЩИК
Сомнения и конфронтации относительно атомов начали ослабевать в тот момент, когда были открыты составляющие внутренней структуры атома: сначала электроны, позже протоны, несколько десятилетий спустя — нейтроны. От химиков работа перешла в руки физиков (хотя часто сферы исследования обеих дисциплин пересекаются). Французский физик и философ науки Анри Пуанкаре (1854-1912) так охарактеризовал поворот, произошедший в отношении атомов:
"Атомная гипотеза в последнее время стала такой основательной, что больше не кажется гипотезой: атомы — не просто полезная выдумка, мы можем сказать, что видим их, так как способны их подсчитать".
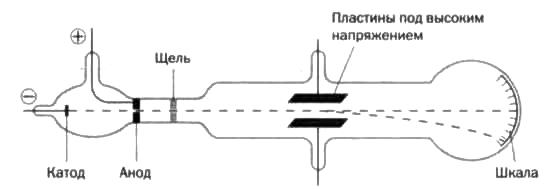
РИС .6
АТОМНАЯ СТРУКТУРА
В 1897 году появилась возможность измерить удельный заряд электрона. Британский физик Джозеф Джон Томсон (1856-1940) впервые обнаружил отрицательно заряженные частицы, которые получили название электронов. Открытие их природы и основной характеристики стало большим достижением.

РИС. 7
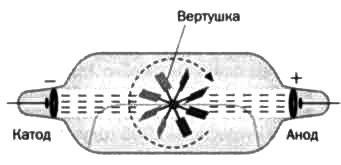
РИС . 8

РИС . 9
Этот прорыв оказался возможным благодаря катодным лучам, представляющим собой электронные пучки, то есть поток электронов, испускаемых трубкой Крукса с небольшим количеством разреженного газа и впаянными в нее анодом и катодом (см. рисунок 6). При разности потенциалов появляются катодные лучи (электронные пучки), дающие зеленоватый флуоресцентный свет при прохождении через край стеклянной трубки. Их основная характеристика — прямолинейное перемещение — была обнаружена, когда посередине трубки установили объект и на дальней стенке появилась его тень (см. рисунок 7).
Также отмечалось, что при столкновении с объектом лучи могли сдвигать его вертушкой (см. рисунок 8). Это означало, что лучи состоят из частиц, обладающих массой. Затем выяснилось, что лучи обладают отрицательным зарядом, поскольку при воздействии на лучи магнитным полем проекция на стекле перемещалась относительно прямой траектории, так как лучи притягивались магнитом при наведении положительного полюса и отдалялись при приближении отрицательного (см. рисунок 9). Так Томсон идентифицировал электроны.
Ученый назвал их " корпускулами", а слово "электрон" было введено Джорджем Джонстоном Стони (1826-1911), их отличительная характеристика заключается в том, что они обнаруживались во всех элементах. Томсон доказал, что вне зависимости от происхождения корпускул и от выбора элементов, частицы демонстрируют одинаковые физические свойства. Томсон говорил об открытии следующее:
"Так как любой химический элемент способен производить электроны, мы можем заключить, что они входят в состав всех атомов.
Мы сделали первый шаг в понимании строения атомов".
Томсон первым увидел элемент структуры атома. Однако это открытие требовало поиска ответов на новые вопросы. Если у атома нейтральный заряд, что же внутри него противостоит отрицательно заряженным электронам?
РАЗМЕР АТОМОВ
Броуновское движение — это атомное явление, которое нетрудно увидеть, необходимы только микроскоп и частицы пыльцы. Однако в течение десятилетий ему не находилось объяснения. В 1827 году шотландский ботаник Роберт Броун наблюдал, как частицы пыльцы беспорядочно двигались без очевидной причины в воде, хотя должны были пребывать в состоянии покоя. Вот почему Броун заинтересовался этим движением. Только Альберт Эйнштейн рискнул дать ему объяснение в одной из своих статей, опубликованных в "чудесном· 1905 году. Эйнштейн пришел к выводу, что движение было вызвано воздействием атомов воздуха и воды на частицы пыльцы. Атомы газа находятся в постоянном движении, но их размер не позволяет нам наблюдать за ними.
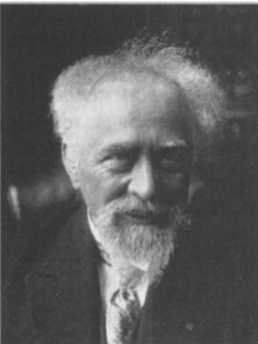
Французский физик Жан-Батист Паррен, 1926 год.
Частицы пыльцы достаточно легкие, поэтому движение атомов воздействует на них; с другой стороны, они достаточно крупные, чтобы наблюдать за ними. Mo есть еще одно доказательство атомной теории.
Вклад Перрона
Идеи Эйнштейна требовали эмпирической поддержки. И эту поддержку дала работа Жана-Батиста Перрена (1870-1942), за которую в 1926 году тот был удостоен Нобелевской премии в области физики. Перрен использовал ультрамикроскоп, благодаря чему определил размер молекулы воды и составляющих ее атомов. В1913 году он опубликовал свои результаты: размер атома составляет 10-10 м. Перрен был привлечен к исследованиям строения атома и предложил изменить модель Томсона, отмечая, что электроны должны располагаться на внешней поверхности атома (иначе говоря, изюм должен находиться на поверхности пудинга). В любом случае речь шла об относительно корректной догадке.
А принимая во внимание низкую массу электронов, в чем содержится основная масса атома? В 1899 году Томсон так описал свои сомнения относительно заряда:
"Хотя автономно электроны ведут себя как отрицательно заряженные ионы, в составе атома нечто противопоставляется их отрицательному заряду; пространство, в котором они находятся, имеет положительный заряд, равный общей сумме отрицательных зарядов этих частиц".
Имея на руках такие аргументы, Томсон предложил модель атома, о которой мы уже говорили, — пудинговую модель. Он также хотел объяснить массу атома, отталкиваясь исключительно от электронов. Но по отдельности электроны обладают малой массой, это заставляло думать, что в атоме содержится чрезвычайно много электронов. Гипотезу отвергли, когда было установлено, что количество электронов в атоме должно совпадать с порядковым номером элемента в периодической системе. В модели Томсона не учитывалось слишком многое.
НЕСООБРАЗНАЯ ПЛАНЕТАРНАЯ СИСТЕМА
Осуществленный именно в этот момент эксперимент Резерфорда, который был описан в предыдущей главе, произвел эффект разорвавшейся бомбы. Новозеландский химик и физик попал в яблочко атомного ядра, навсегда изменив наше представление об атоме.
Строение атома, каким его обозначил Резерфорд, напоминало Солнечную систему в миниатюре. Ядро, занимающее центральное положение, было как звезда, а электроны, как планеты, вращались вокруг него. Концепция Резерфорда стала своеобразным каркасом, который на базовом уровне объясняет строение атомов. Но, как и всякое выдающееся научное открытие, это дало больше вопросов, чем ответов. В каком порядке располагаются электроны вокруг ядра? Из чего состоит ядро? Было и одно самое существенное неизвестное.
В 1911 году, создав эту модель, Резерфорд совершил величайшую со времен Демокрита перемену во взгляде на материю.
Сэр Артур Эддингтон (1882-1944), британский астрофизик
Согласно этой модели электрон вращается вокруг ядра, ввиду противоположного знака его заряда. Но по законам классической термодинамики, вращаясь, электрон должен испускать излучение и, соответственно, терять энергию. Это означает, что рано или поздно электрон должен упасть на ядро. Это стало бы катастрофой и разрушило бы всю окружающую нас реальность. Но материя стабильна, таким образом какой-то из известных законов или модель пребывает в явном противоречии. Проще всего было усомниться в предложенной модели атома, а не в принятых научным сообществом теориях, например в электромагнетизме. Однако имелись неоспоримые доказательства того, что модель Резерфорда верна. Согласно ей стабильность атома невозможна, но именно это мы и наблюдаем. Представляя свое открытие Королевскому обществу в 1911 году, он не скрывал собственного удивления подобному положению вещей. Для того чтобы объяснить строение атома, требовались новые законы, так как законы, управляющие объектами макроскопического мира, по видимости, здесь были неприменимы.

Эрнест Резерфорд, 1908 год.

Британский физик Джозеф Джон Томсон, руководитель Резерфорда в Кавеидишской лаборатории, первооткрыватель электрона, поставивший эксперимент с потоком частим (электронов) катодных лучей.

Немецкий физик Ханс Вильгельм Гейгер (слева) и Эрнест Резерфорд.
НИЛЬС БОР
Датский физик Нильс Хенрик Давид Бор (1885-1962) родился в Копенгагене. Его отец был врачом и дважды становился претендентом на Нобелевскую премию, мать происходила из состоятельной семьи. Бор изучал физику в Копенгагенском университете.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК