14.1. Окислители и восстановители
Окислительно-восстановительные реакции протекают с одновременным повышением и понижением степеней окисления элементов и сопровождаются передачей электронов:
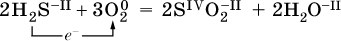
Повышение степени окисления элемента в ходе реакции, отвечающее потере электронов атомами этого элемента, называют окислением: S-II – 6е- = SIV. В данном примере S-II окисляется до SIV.
Понижение степени окисления элемента в ходе реакции, отвечающее присоединению электронов атомами этого элемента, называется восстановлением: O0 + 2е- = О-II. В данном примере О0 восстанавливается до O-II.
Вещество, частицы которого содержат окисляющиеся атомы, выполняет в реакции функцию восстановителя. В данном примере восстановитель – сероводород H2S.
Вещество, частицы которого содержат восстанавливающиеся атомы, выполняет в реакции функцию окислителя. В данном примере окислитель – молекулярный кислород O2.
Вещества, являющиеся окислителями или восстановителями во многих реакциях, называются типичными (сильными).
Многие вещества могут проявлять как окислительные, так и восстановительные свойства. К таким веществам принадлежат соединения, содержащие элементы в промежуточной (для них) степени окисления:
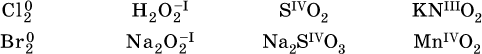
Окислительно-восстановительные свойства веществ связаны с положением элементов в Периодической системе Д. И. Менделеева. Простые вещества – неметаллы обладают б?льшими окислительными свойствами, а металлы – б?льшими восстановительными свойствами (O2, Cl2 – окислители; Na, Ва, Al и Zn – восстановители).
В каждой группе Периодической системы элемент с большим порядковым номером будет обладать и б?льшими восстановительными свойствами в своей группе, а элемент с меньшим порядковым номером – б?льшими окислительными свойствами. Так, кальций Са – более сильный восстановитель, чем магний Mg, молекулярный хлор Cl2 – более сильный окислитель, чем иод I2.
Соединения, содержащие атомы элементов в низкой степени окисления, будут восстановителями за счет этих атомов, например: NH3 – восстановитель за счет азота (-III), H2S – за счет серы (-II), KI – за счет иода (-I) и т. д.
Соединения, включающие атомы элементов в высокой степени окисления, будут окислителями, например: HNO3 – окислитель за счет азота (+V), КMnO4 – за счет марганца (+VII), К2Cr2O7 – за счет хрома (+VI) и т. д.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК