2. Уравнение изотермы химической реакции
2. Уравнение изотермы химической реакции
Если реакция протекает обратимо, то ?G= 0.
Если реакция протекает необратимо, то ?G? 0 и можно рассчитать изменение ?G.
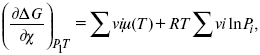
где ? – пробег реакции – величина, которая показывает, сколько молей изменилось в ходе реакции. I сп – характеризует равновесное и неравновесное состояние реакции, II сп – характеризует только неравновесные состояния.
Если
д? = 1,
то
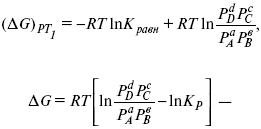
это уравнение изотермы химической реакции.
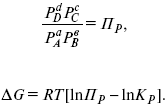
С помощью уравнения изотермы химической реакции можно судить о направлении протекания реакции.
1) Пp< Кp, ?G < 0, слева направо;
2) Пp> Кp, ?G > 0, справа налево;
3) Пp= Кp, ?G = 0, химическое равновесие.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
УПРАВЛЯЕМЫЕ ТЕРМОЯДЕРНЫЕ РЕАКЦИИ
УПРАВЛЯЕМЫЕ ТЕРМОЯДЕРНЫЕ РЕАКЦИИ Неуправляемые термоядерные реакции происходят при взрывах водородных бомб. Они приводят к высвобождению громадного количества ядерной энергии, сопровождающемуся крайне разрушительным взрывом. Теперь задача ученых — найти пути
2. Уравнение состояния идеального газа
2. Уравнение состояния идеального газа Изучение эмпирических газовых законов (Р. Бойль, Ж. Гей-Люссак) постепенно привело к представлению об идеальном газе, поскольку обнаружилось, что давление данной массы любого газа при постоянной температуре обратно пропорционально
4. Уравнение состояния реального газа
4. Уравнение состояния реального газа Исследования показали, что уравнение Менделеева – Клапейрона не очень точно выполняется при исследовании разных газов. Голландский физик Я. Д. Ван-дер-Ваальс первым понял причины этих отклонений: одна из них состоит в том, что
3. Уравнения изохоры, изобары химической реакции
3. Уравнения изохоры, изобары химической реакции Зависимость К от температуры Уравнение изобары: Уравнение изохоры: По ним судят о направлении протекания
1. Понятие химической кинетики
1. Понятие химической кинетики Кинетика – наука о скоростях химических реакций.Скорость химической реакции – число элементарных актов химического взаимодействия, протекающих в единицу времени в единицу объема (гомогенные) или на единице поверхности
2. Факторы, влияющие на скорость химической реакции
2. Факторы, влияющие на скорость химической реакции Для гомогенных, гетерогенных реакций:1) концентрация реагирующих веществ;2) температура;3) катализатор;4) ингибитор.Только для гетерогенных:1) скорость подвода реагирующих веществ к поверхности раздела фаз;2) площадь
ЯДЕРНЫЕ РЕАКЦИИ
ЯДЕРНЫЕ РЕАКЦИИ МЕТОДЫ БОМБАРДИРОВКИ ЯДЕР1.40. Кокрофт и Уолтон получали протоны с достаточно большой энергией путем ионизации газообразного водорода и последующего ускорения ионов высоковольтной установкой с трансформатором и выпрямителем. Подобный же метод можно
Глава 7. Уравнение и Эйнштейн
Глава 7. Уравнение и Эйнштейн Когда в 1905 году Эйнштейн обнародовал свое уравнение, Е=mc2, на него почти не обратили внимания. Оно попросту не согласовывалось с тем, чем занималось большинство других ученых. Великие открытия Фарадея, Лавуазье и прочих были доступны всем,
25. Уравнение профессора
25. Уравнение профессора В «Интерстеллар» гравитационные аномалии волнуют профессора Брэнда по двум причинам. Если он поймет их природу, это может привести к революционному скачку в наших познаниях о гравитации, к скачку столь же грандиозному, как эйнштейновская
И наконец, уравнение профессора!
И наконец, уравнение профессора! Законы физики описываются языком математики. Еще до того, как Купер встретил профессора Брэнда (в Кип-версии), профессор пытался составить математическое описание полей балка и их проявлений – того, как они порождают аномалии,
Глава 25. Уравнение профессора
Глава 25. Уравнение профессора Идеи об изменении ньютоновской гравитационной константы G в зависимости от места и времени, а также о том, что этими изменениями можно управлять с помощью некоего негравитационного поля, были очень популярны на физическом факультете
Глава 25. Уравнение профессора
Глава 25. Уравнение профессора Смысл различных математических символов, входящих в уравнение профессора (рис. 25.7), раскрыт на остальных пятнадцати досках, фотографии которых можно найти на сайте Interstellar.withgoogle.com в разделе, посвященном этой книге. Уравнение выражает