ЛЕКЦИЯ № 10. Гальванические элементы
ЛЕКЦИЯ № 10. Гальванические элементы
1. Понятие гальванического элемента
Гальванический элемент – прибор, который преобразовывает химическую энергию в электрическую. Одним из таких элементов является элемент Даниэля – Якоби. Этот элемент состоит из двух электродов: цинкового и медного, – погруженных в соответствующие сульфатные растворы, между которыми пористая перегородка:
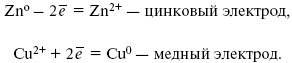
При замыкании внешней цепи электроны переходят от Zn к Cu, происходит диффузия цинка в медь:
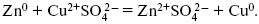
Образуем электрохимическую схему:
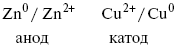
Анод – отрицательный электрод (слева). Катод – положительный электрод.
Для определения ЭДС этого элемента нужно сравнить стандартные электродные потенциалы обоих электродов. При записи электродных реакций принято, что окисленная форма находится в левой части, а восстановленная – в правой части уравнения.
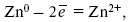
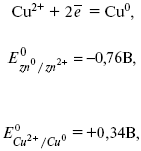
где E0 – электродвижущая сила (ЭДС) гальванического элемента, когда все реагенты в стандартном состоянии.
ЭДС элемента вычисляется вычитанием из потенциала катода потенциала анода.
ЭДС элемента равна +0,34 – (–0,76) = 1,1 В; чем больше электродные потенциалы отличаются друг от друга, тем больше ЭДС. Если погрузить металл в раствор соли большей концентрации, то потенциал нестандартный. Значит, на величину электродного потенциала влияет концентрация и температура. Такая зависимость выражается уравнением В. Нернста.
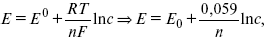
где п – число ионов;
R – универсальная газовая постоянная;
Т – температура;
С – концентрация активных ионов в растворе;
F – число Фарадея = 96500 В.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
ТРАНСУРАНОВЫЕ ЭЛЕМЕНТЫ
ТРАНСУРАНОВЫЕ ЭЛЕМЕНТЫ Периодическая система природных элементов, как известно, обрывается на 92-м члене. Самым тяжелым природным элементом является уран. Ни на Земле, ни в приходящих из космоса метеоритах никто не находил каких-либо заметных следов более тяжелых
1. Элементы молекулярно-кинетической теории
1. Элементы молекулярно-кинетической теории Науке известно четыре вида агрегатных состояний вещества: твердое тело, жидкость, газ, плазма. Переход вещества из одного состояния в другое называют фазовым переходом. Вода, как известно, существует в трех агрегатных
ЛЕКЦИЯ № 2. Химическая термодинамика
ЛЕКЦИЯ № 2. Химическая термодинамика Химическая термодинамика – наука, изучающая условия устойчивости систем и законы.Термодинамика – наука о макросистемах.Она позволяет apriori определить принципиальную невозможность того или иного процесса. Физические и химические
ЛЕКЦИЯ № 3. Растворы
ЛЕКЦИЯ № 3. Растворы 1. Общая характеристика растворов Растворы – термодинамически устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это дисперсные системы, состоящие из дисперсной фазы и дисперсионной
ЛЕКЦИЯ № 4. Катализ
ЛЕКЦИЯ № 4. Катализ 1. История открытия явления катализа Катализ – изменение скорости химической реакции в присутствии катализаторов. Самые простые научные сведения о катализе были известны уже к началу XIX в. Знаменитый русский химик, академик К. С. Кирхгоф, открыл в 1811 г.
ЛЕКЦИЯ № 6. Химическая кинетика
ЛЕКЦИЯ № 6. Химическая кинетика 1. Понятие химической кинетики Кинетика – наука о скоростях химических реакций.Скорость химической реакции – число элементарных актов химического взаимодействия, протекающих в единицу времени в единицу объема (гомогенные) или на единице
ЛЕКЦИЯ № 7. Коррозия металлов
ЛЕКЦИЯ № 7. Коррозия металлов 1. Основные понятия и терминология Коррозия – самопроизвольное окисление металлов, вредное для промышленной практики (уменьшающее долговечность изделий). Это слово произошло от латинского corrodere – разъедать. Среда, в которой металл
ЛЕКЦИЯ № 9. Термохимия
ЛЕКЦИЯ № 9. Термохимия 1. Понятие термохимии Раздел физической химии и химической термодинамики, изучающий тепловые процессы теплоемкости веществ, называется термохимией.?Q = dU + ?A– первый закон термодинамики. ?Q – не является функцией состояния. P = const || V = const – функции
ЛЕКЦИЯ № 11. Электрохимия
ЛЕКЦИЯ № 11. Электрохимия 1. Понятие электрохимии Электрохимия – раздел физической химии, который рассматривает системы, содержащие ионы (растворы или расплавы электролитов) и процессы, протекающие на границе двух фаз с участием заряженных частиц.Первые представления о
ЛЕКЦИЯ № 12. Теоретическая электрохимия
ЛЕКЦИЯ № 12. Теоретическая электрохимия 1. Ассоциации в растворах электролитов. Понятие о теории сильных электролитов. Активность При увеличении концентрации растворов электролитов создаются условия, когда за счет электростатического взаимодействия становится
ЛЕКЦИЯ № 13. Электрохимическая кинетика
ЛЕКЦИЯ № 13. Электрохимическая кинетика 1. Основные кинетические характеристики и методы их расчетов i0 – ток обмена – кинетическая характеристика равновесия между электродом и раствором при равновесном значении электродного потенциала. Токи обмена относят к 1 см2
Спектрограф обнаруживает неизвестные элементы
Спектрограф обнаруживает неизвестные элементы Спектрограф стал незаменимым помощником химика.До появления спектрографа существовали элементы, которые скрывались от глаз химика, от его приборов, от его средств исследования. Чувствительность тех средств исследования,
I. Химические элементы
I. Химические элементы 1. Количество элементов. Периодическая система элементов Менделеева.В отличие от химических соединений, которых в природе существует очень много (3,5 тыс. соединений из общего количества 300 тыс., известных нам на сегодняшний день), количество простых
Элементы
Элементы Из чего построен окружающий нас мир? Первые дошедшие до нас ответы на этот вопрос родились в Древней Греции более 25 веков тому назад.Ответы кажутся на первый взгляд донельзя странными, и мы должны были бы потратить много бумаги, чтобы объяснить читателю логику
Березовчук А В
Просмотр ограничен
Смотрите доступные для ознакомления главы 👉