Опероны Е. coli
Опероны Е. coli
Молекулярная подвижность Е. coli зависит от оперонов — генетических единиц, расположенных на молекуле ДНК, хромосоме, и состоящих из кластера генов с соответствующими функциями. Один из оперонов называется lac-опероном ввиду ключевой роли в метаболизме молочного сахара (лактозы). Lac-оперон содержит три гена, отвечающих за выработку трех белков, импортирующих лактозу в клетку и расщепляющих ее на глюкозу и другой сахар, галактозу.
Рассмотрим, как foc-оперон участвует в метаболическом процессе при добавлении лактозы в обычно богатую глюкозой питательную среду. Лактоза, молочный сахар, сложнее глюкозы и состоит из глюкозы с галактозой, образующих одну молекулу, дисахарид (рис. 4.1). После добавления лактозы к среде с присутствием Е. coli происходит то, что описывалось выше. Е. coli переваривает глюкозу, оставляя в неприкосновенности лактозу. Но при нехватке глюкозы в ход идет и она.
Крайне любопытно поведение при этом Е. coli. На время все замирает. Е. coli не влияет на лактозу, другие метаболические реакции идут на убыль, и клетка перестает делиться. Настают трудные времена для Е. coli. Но вскоре начинает действовать лактоза, затем Е. coli. Изучение химических процессов клетки выявляет три новых белка, которых не было, пока хватало глюкозы.

Рис. 4.1. Молекулы глюкозы и лактозы
Эти белки состоят из [галакзид — ]пермеазы, препровождающей молекулы лактозы через мембрану клетки, где они перевариваются; бета-галактозидазы, расщепляющей лактозу на глюкозу и галактозу; и [тиога-лактизид — ]трансацетилазы, чья роль еще полностью не выяснена.
Оперон ДНК — РНК — белки.
Представляется, что присутствие лактозы в клетке служит пусковым механизмом, приводящим в действие транскрипцию РНК, которая производит эти три белковых фермента. На самом же деле все обстоит значительно сложнее. Сигнал к производству различных белковых ферментов задается одновременно наличием лактозы и отсутствием глюкозы. Рассмотрим этот процесс на молекулярном уровне, чтобы выяснить его механизм.
ДНК порой представляют в виде обособленной молекулы, надежно защищенной благодаря своему крепкому сложению, хранящей жизненно важную для клетки информацию. Но это далеко не так. В действительности ДНК постоянно прощупывают, крутят, тормошат, раскрывают различные белковые ферменты. Такая деятельность заставляет эту информационную магистраль изрядно выкладываться.
Все эти действия обусловлены обликом ДНК и распределением электрического заряда. Двойная спираль имеет бороздки, маленькую и большую, а все нуклеотидные основания обладают только им присущим распределением электрического заряда (см.: Список идей, 6. Сборка модели ДНК, где рассказывается, как собирать часть ДНК из набора конструктора). Некоторые белки имеют размер и очертание, приходящиеся «впору» этим бороздкам. Благодаря распределению электрического заряда у белков и ДНК они могут плотно прилегать друг к другу. Однако притяжение не столь сильно, как ковалентные связи внутри каждой молекулы. Такое вкладывание одной молекулы в другую называют связыванием.
В зависимости от формы и распределения заряда белки присоединяются в соответствующих местах вдоль ДНК. Ввиду теплового движения молекул белки постоянно связываются и отделяются.
Соответствие сложных молекулярных очертаний часто представляется аналогичным ключу и замку. Лишь немногие очертания в достаточной степени соответствуют друг другу для соединения молекул. Белки тоже могут связываться с другими белками, образуя новую единицу под названием комплекс. Обычно комплекс приобретает иные по сравнению с исходной молекулой очертание и распределение заряда. Такую перемену, играющую главную роль в сборке белка, поскольку меняются «ключи» и «замки», именуют конформационным изменением.
РНК собирается с помощью белкового фермента (полимеразы), который прикрепляется к связывающей стороне ДНК, распускает двойную спираль посередине подобно «змейке» и переписывает (транскрибирует) порядок парных оснований ДНК на молекулу РНК. Затем РНК покидает ДНК и переносит (транслирует) порядок парных нуклеотидных оснований, собирая белок на молекулярном устройстве под названием рибосома. Каждая группа из трех нуклеотидных оснований, именуемая кодоном (см.: Список идей, 7. Кодоны), определяет, какую аминокислоту добавить к белку. Полимераза РНК связывается с ДНК лишь в тех местах, где приходится впору. Это прилаживание определяется не только очертанием молекулы полимеразы, но и наличием места связывания у ДНК, которое в свою очередь зависит от изгибов ДНК.
Для получения полной картины метаболического процесса на основе лактозы недостает трех молекул. Прежде всего, это белок-активатор катаболизма (БАК-белок). В обычном состоянии строение БАК-белка не позволяет ему соединяться с ДНК. БАК-белок содержит место для связывания с другой молекулой, циклическим аденозинмонофосфатом (цАМФ). Молекула цАМФ вырабатывается в среде, где отсутствует глюкоза. Если цАМФ связан с БАК-белком, БАК-белок претерпевает конформационное изменение, позволяющее ему присоединяться к ДНК. В свою очередь, связывание комплекса БАК-белок/цАМФ с ДНК Е. coli заставляет ДНК сгибаться, как показано на рис. 4.2.
На заключительном этапе требуется наличие другого белка, действующего в качестве репрессора. В данном случае он называется lac-репрессором. Эта молекула обычно входит в бороздку ДНК в том месте, где нужно помешать закрепиться полимеразе РНК, переписывающей информацию ДНК на белки, которые усваивают лактозу.
Если лактоза не соединена с lac-репрессором, репрессор точно входит в бороздку ДНК в нужном месте, препятствуя выполнению полимеразой РНК возложенной на нее задачи перезаписи (транскрипции). Если лактоза соединена с lac-репрессором, это вызовет в репрессоре конформационные изменения, так что он уже не будет подходить бороздке ДНК Е. coli и не будет мешать полимеразе ДНК выполнять транскрипцию.
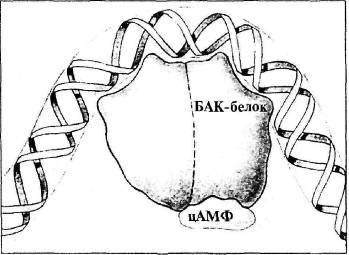
Рис. 4.2. Связь цАМФ с БАК-белком, а БАК-белка — с ДНК (из кн.: Raven P. H., Johnson G. В. Biology)
Рассмотрим, как эти молекулы сотрудничают, определяя наблюдаемую линию поведения Е. coli. В исходных условиях имеется глюкоза и отсутствует лактоза. При наличии глюкозы цАМФ не вырабатывается, а значит, не образовывается комплекс БАК-белок/цАМФ, не сгибается ДНК и полимераза РНК не переписывает белки для усвоения лактозы. Помимо этого, репрессор находится на ДНК, препятствуя соединению полимеразы РНК с ДНК в этом месте. Получается двойная блокировка перезаписи (рис. 4.3 а).
В смешанной среде с глюкозой и лактозой присутствие глюкозы препятствует образованию комплекса БАК — белок/ цАМФ, так что ДНК не изгибалась, а полимераза РНК не занималась перезаписью. Даже если присутствие лактозы вынудит репрессор покинуть бороздку ДНК, полного связывания полимеразы РНК не произойдет. Она покидает ДНК, так и не прикрепившись ни к одному из участков lac-оперона.

Рис. 4.3. Lac-peпpeccop (из кн.: Raven P. H., Johnson G. В. Biology)
В отсутствие глюкозы и лактозы появляется комплекс БАК-белок/цАМФ, изгибается ДНК в ожидании РНК, но при этом наличествует и репрессор. С точки зрения Е. coli отсутствие пищи означает предстоящий голод. Но мы видим, насколько она готова к возможному повороту событий. Если появится глюкоза, она не станет расходовать энергию на выработку белковых ферментов, а сразу приступит к усваиванию глюкозы. Если же появится лактоза, изогнувшаяся ДНК уже готова к сборке нужной РНК, стоит лишь лактозе соединиться с репрессором, который тотчас покидает ДНК (рис. 4.3 б).
В отсутствие глюкозы и при наличии лактозы происходит следующее. Недостаток глюкозы приводит к образованию комплекса БАК-белок/цАМФ, который соединяется с ДНК, вынуждая ее изгибаться. Это дает возможность полимеразе РНК отыскать свое место прикрепления. Присутствие лактозы приводит к ее связыванию с lac-репрессором и отсоединению репрессора от ДНК, так что уже вся полимераза РНК может присоединиться к ДНК и собрать три белка для усвоения лактозы (рис. 4.3 в).
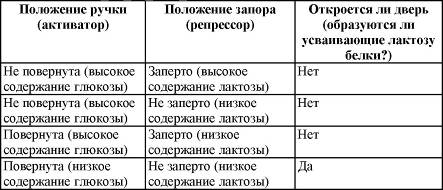
Подобное положение дел сходно с ситуацией с дверью, снабженной ручкой и засовом. Ручка действует подобно активатору, а запор выступает в роли репрессора. В таблице действие системы «ручка — засов» сравнивается с механизмом «активатор — репрессор».
Эта сложная система управления схожа со старым устройством Руба Голдберга,[8] где целая цепь сложных событий служит для достижения некой простой цели (рис. 4.4). И все же почему при всей затратности данного механизма Е. coli не вырабатывает постоянно все нужные ферменты, чтобы усваивать любой поступающий к ней сахар? Возможно, некогда такая бактерия и существовала.
Но появившаяся в ходе мутаций Е. coli с ее lac-опероном благодаря значительно большему по сравнению со своей старшей родственницей коэффициенту полезного действия вытеснила ее. Наглядный пример классического естественного отбора.
Белковые ферменты собираются практически одновременно с перезаписью РНК, когда РНК все еще прикреплена к длинной кольцевой молекуле ДНК. Поскольку Е. coli относится к прокариотным клеткам, у нее нет тормозящих ход метаболизма ядра или ядерной мембраны, так что усвоение лактозы начинается очень скоро. Е. coli прекрасно живет и на лактозе, и на глюкозе.
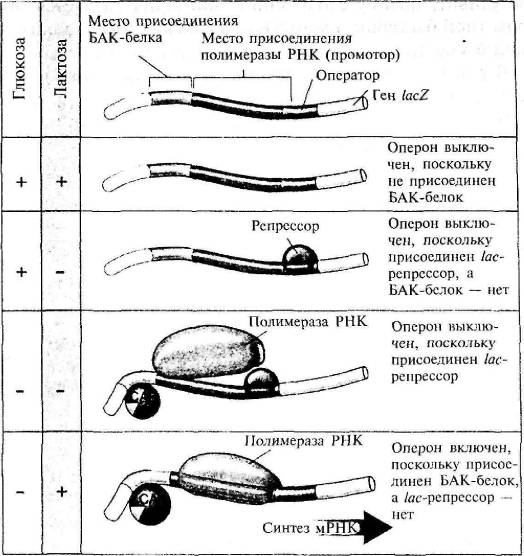
Рис. 4.4. Действие lac-оперона на молекулярном уровне (из кн.: Raven P. H., Johnson G. В. Biology)
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Е. coli
Е. coli Быстро ешь, быстро расти, быстро размножайся, быстро реагируй… Для клеток спешка — образ жизни.Каким-то образом молекулы осуществляют все эти жизненно важные отправления клетки. Согласно основам молекулярной биологии сообщение от ДНК переписывается
Е. coli и другие организмы
Е. coli и другие организмы Е. coli — одно из наиболее изученных живых существ; исследователи выявили примерно две трети функций ее генов. Механизм задействования lac-оперона составляет лишь малую часть молекулярных отправлений Е. coli. Возможно, вас удивит, почему столь много