Платиновые металлы 245. Общая характеристика платиновых металлов.
Под общим названием платиновых металлов объединяются элементы второй и третьей триад восьмой группы периодической системы: рутений, родий, палладий, осмий, иридий и платина. Эти элементы образуют группу довольно редких металлов, по своим свойствам сходных друг с другом, так что разделение их представляет значительные трудности.
В природе платиновые металлы встречаются почти исключительно в самородном состоянии, обычно все вместе, но никогда не встречаются в железных рудах.
Будучи сильно распылены по различным горным породам, платиновые металлы стали известны человечеству сравнительно недавно. Раньше других, в 1750 г., было установлено существование платины. Затем, в начале XIX века были открыты палладий, родий, осмий и иридий. Последний платиновый металл — рутений — был открыт только в 1844 г. профессором Казанского университета К. К. Клаусом, назвавшим его в честь нашей страны (Ruthenia — Россия).
Некоторые свойства платиновых металлов приведены в табл. 40.
Таблица 40. Некоторые свойства платиновых металлов
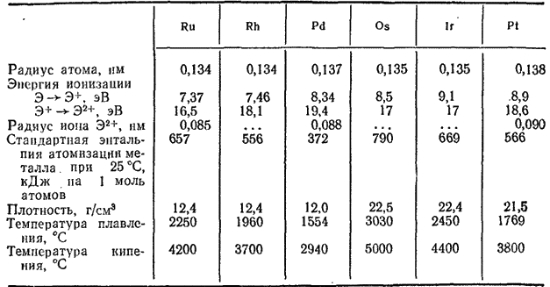
Платиновые металлы малоактивны и весьма стойки к химическим воздействиям. Некоторые из них не растворяются не только в кислотах, но и в царской водке.
Рутений, родий, осмий и иридий тугоплавки. Несмотря на малую доступность и дороговизну, эти металлы, наряду с платиной, имеют разностороннее, год от года возрастающее техническое применение.
Хотя платиновые металлы могут проявлять в соединениях различные степени окисленности, но особенно типичны для них соединения, в которых их степень окисленности равна +4. Для осмия и рутения характерны также соединения со степенью окисленности этих элементов +8.
Оксид осмия (VIII), или тетраоксид осмия, OsO4 - наиболее стойкий из оксидов этого элемента. Он медленно образуется уже при хранении осмия на воздухе и представляет собой легкоплавкие (темп, плавл. 41°C) кристаллы бледно-желтого цвета. Пары OsO4 обладают резким запахом и весьма ядовиты.
Тетраоксид осмия довольно хорошо растворяется в воде, причем раствор его не дает кислой реакции на лакмус. Однако, как это впервые было установлено Л. А. Чугаевым (1918 г.), с сильными щелочами OsO4 образует непрочные комплексные соединения.
Обладая резко выраженными окислительными свойствами, OsO4 энергично реагирует с органическими веществами, восстанавливаясь при этом до черного диоксида осмия OsO2 На этом основано применение OsO4 для окрашивания микроскопических препаратов.
Оксид рутения(VIII), или тетраоксид рутения, RuO4 - твердые кристаллы золотисто-желтого цвета, плавящиеся при 25.4°C и растворимые в воде. Тетраоксид рутения значительно менее устойчив, чем OsO4, и при температуре около 108°C (ниже температуры кипения) разлагается со взрывом на RuO2 и кислород.
Фторид осмия (VIII), или октафторид осмия, OsF8 получается путем прямого соединения осмия с фтором при 250°C в виде бесцветных паров, сгущающихся при охлаждении в лимонно-желтые кристаллы с температурой плавления — 34.4°C.
Октафторид осмия проявляет резко выраженные окислительные свойства. Водой он постепенно разлагается на тетраоксид осмия и фтористый водород:
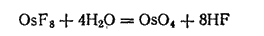
Все платиновые металлы проявляют ярко выраженную склонность к комплексообразованию.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК