ЛЕКЦИЯ № 5. Химическое равновесие
ЛЕКЦИЯ № 5. Химическое равновесие
1. Понятие химического равновесия. Закон действующих масс
При протекании химической реакции через некоторое время устанавливается химическое равновесие. Существует два признака химического равновесия: кинетический, термодинамический. В кинетическом – ?пр = ?обр, в термодинамическом – характеризует химическую реакцию при условиях P, t – const (?G = 0); при условиях V, Т – const (?F = 0).
Химический потенциал – функция, которая характеризует состояние i-го компонента при определенных внешних условиях.
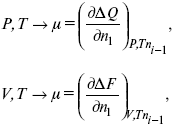
где n1 – число молей i-го компонента.
Если к бесконечно большому количеству раствора прибавить определенное количество какого-нибудь компонента, то химический потенциал системы определяется изменением изобарного потенциала при изобарных условиях или изменением изохорного потенциала при изохорных условиях.
Химический потенциал зависит от концентрации данного компонента
?i = ?0 + RTLnPi– (для идеального газа),
где Рi– парциальное давление – вклад каждого компонента в общее давление или давление, которое компонент имел бы, если бы находился в смеси.
Парциальное давление – элементарная функция (можно складывать). Пример (O2, N2, H2) – их общее давление
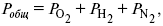
?i= ?0+ RTLnCi – (для раствора),
?0– значение химического потенциала при стандартных условиях.
Химический потенциал характеризует способность данного компонента выходить из данной фазы путем испарения, растворения, кристаллизации и т. д. Переход этот происходит произвольно.
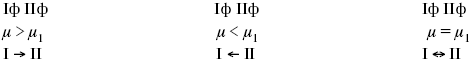
В результате химического равновесия скорость прямой реакции уменьшается, а скорость обратной реакции увеличивается.
Концентрации, которые соответствуют химическому равновесию, называются равновесными концентрациями. Связь между равновесными концентрациями устанавливается законом действующих масс (ЗДМ). Этот закон в 1867 г. вывели К. М. Гульберг и П. Вааге.
Кинетический вывод ЗДМ
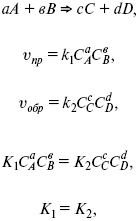
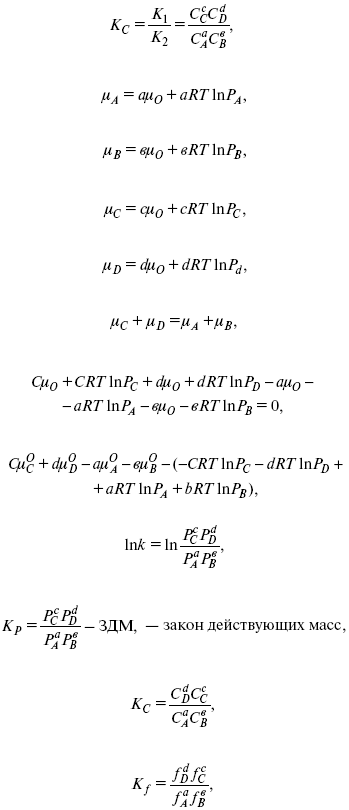
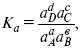
f – фугитивность – парциальное давление для реальных газов. Возникает вопрос, будут ли равняться Кpи Кс.
Кpи Кc– отличаются на RT ?vi в сумме стехиометрических коэффициентов.
Связь между Кpи Кс
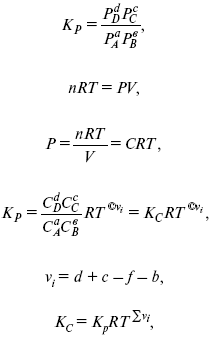
если ?vi = 0, то Kp = Kc. ?vi = 1 + 1 – 1 – 1 =0 – когда стехиометрический коэффициент = 1.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Лекция 3. Великие законы сохранения
Лекция 3. Великие законы сохранения Изучая физику, вы обнаруживаете, что существует огромное количество сложных и очень точных законов - законы гравитации, электричества и магнетизма,законы ядерных взаимодействий и т.д. Но все это многообразие отдельных законов
Лекция 5. Различие прошлого и будущего
Лекция 5. Различие прошлого и будущего Каждому ясно. что события, происходящие в нашем мире, явно необратимы. Другими словами, все происходит так, а не наоборот. Роняешь чашку, она разбивается, и сколько ни жди, черепки не соберутся снова и чашка не прыгнет обратно тебе в
ЛЕКЦИЯ № 2. Химическая термодинамика
ЛЕКЦИЯ № 2. Химическая термодинамика Химическая термодинамика – наука, изучающая условия устойчивости систем и законы.Термодинамика – наука о макросистемах.Она позволяет apriori определить принципиальную невозможность того или иного процесса. Физические и химические
ЛЕКЦИЯ № 3. Растворы
ЛЕКЦИЯ № 3. Растворы 1. Общая характеристика растворов Растворы – термодинамически устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это дисперсные системы, состоящие из дисперсной фазы и дисперсионной
ЛЕКЦИЯ № 4. Катализ
ЛЕКЦИЯ № 4. Катализ 1. История открытия явления катализа Катализ – изменение скорости химической реакции в присутствии катализаторов. Самые простые научные сведения о катализе были известны уже к началу XIX в. Знаменитый русский химик, академик К. С. Кирхгоф, открыл в 1811 г.
ЛЕКЦИЯ № 6. Химическая кинетика
ЛЕКЦИЯ № 6. Химическая кинетика 1. Понятие химической кинетики Кинетика – наука о скоростях химических реакций.Скорость химической реакции – число элементарных актов химического взаимодействия, протекающих в единицу времени в единицу объема (гомогенные) или на единице
ЛЕКЦИЯ № 7. Коррозия металлов
ЛЕКЦИЯ № 7. Коррозия металлов 1. Основные понятия и терминология Коррозия – самопроизвольное окисление металлов, вредное для промышленной практики (уменьшающее долговечность изделий). Это слово произошло от латинского corrodere – разъедать. Среда, в которой металл
ЛЕКЦИЯ № 9. Термохимия
ЛЕКЦИЯ № 9. Термохимия 1. Понятие термохимии Раздел физической химии и химической термодинамики, изучающий тепловые процессы теплоемкости веществ, называется термохимией.?Q = dU + ?A– первый закон термодинамики. ?Q – не является функцией состояния. P = const || V = const – функции
ЛЕКЦИЯ № 10. Гальванические элементы
ЛЕКЦИЯ № 10. Гальванические элементы 1. Понятие гальванического элемента Гальванический элемент – прибор, который преобразовывает химическую энергию в электрическую. Одним из таких элементов является элемент Даниэля – Якоби. Этот элемент состоит из двух электродов:
ЛЕКЦИЯ № 11. Электрохимия
ЛЕКЦИЯ № 11. Электрохимия 1. Понятие электрохимии Электрохимия – раздел физической химии, который рассматривает системы, содержащие ионы (растворы или расплавы электролитов) и процессы, протекающие на границе двух фаз с участием заряженных частиц.Первые представления о
ЛЕКЦИЯ № 12. Теоретическая электрохимия
ЛЕКЦИЯ № 12. Теоретическая электрохимия 1. Ассоциации в растворах электролитов. Понятие о теории сильных электролитов. Активность При увеличении концентрации растворов электролитов создаются условия, когда за счет электростатического взаимодействия становится
6. Равновесие в системе жидкость – жидкость
6. Равновесие в системе жидкость – жидкость Равновесие жидкость – жидкостьВ случае ограниченной взаимной растворимости компонентов в жидком состоянии в двухкомпонентной системе осуществляется равновесие двух жидких фаз. Явление образования двух жидких фаз
ЛЕКЦИЯ № 13. Электрохимическая кинетика
ЛЕКЦИЯ № 13. Электрохимическая кинетика 1. Основные кинетические характеристики и методы их расчетов i0 – ток обмена – кинетическая характеристика равновесия между электродом и раствором при равновесном значении электродного потенциала. Токи обмена относят к 1 см2
ЛЕКЦИЯ № 15. Третий закон термодинамики
ЛЕКЦИЯ № 15. Третий закон термодинамики Понятие химического сродства. Известно, что многие вещества реагируют друг с другом легко и быстро, другие вещества реагируют с трудом, а третьи – не реагируют. Исходя из этого, вывели предположение, что между веществами существует
Равновесие
Равновесие В некоторых случаях равновесие очень трудно поддержать – попробуйте пройтись по натянутому канату. В то же время никто не награждает аплодисментами сидящего в кресле-качалке. А ведь он тоже поддерживает свое равновесие.В чем же разница в этих двух примерах? В
Критическая орбита: равновесие центробежных и гравитационных сил
Критическая орбита: равновесие центробежных и гравитационных сил Прибыв на кромку кратера, «Эндюранс» в идеале должен вращаться по ней круг за кругом, с постоянной скоростью. Чтобы он не смещался ни внутрь, ни наружу, гравитационное притяжение черной дыры на кромке