ЛЕКЦИЯ № 15. Третий закон термодинамики
ЛЕКЦИЯ № 15. Третий закон термодинамики
Понятие химического сродства. Известно, что многие вещества реагируют друг с другом легко и быстро, другие вещества реагируют с трудом, а третьи – не реагируют. Исходя из этого, вывели предположение, что между веществами существует какое-то химическое сродство.
1-е предположение – мерой химического сродства была скорость реакции.
2-е предположение – М. Бертло и Х. Томсон высказали, что мерой химического сродства является тепловой эффект.
3-е предположение – max А (Вант-Гофф). Если max А > 0, то химическое сродство между веществами существует, и реакция протекает слева направо. Если Аmax< 0 ?, то химического сродства между веществами нет, и реакция протекает справа налево. Если Аmax= 0, то реакция протекает и туда, и обратно. На основе этого создавался третий закон термодинамики; М. Бертло и Х. Томсон, изучая поведение термодинамических систем при низких температурах, в 1906 г. обнаружили, что при низких температурах между веществами существует так называемое химическое сродство, которое они определили как тепловой эффект, ими было установ-лено, что тепловой эффект Qv – Аmax в конденсированных системах при низких температурах, где Аmax – максимальная работа.
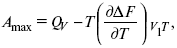
но на самом деле это не max, если исходить из уравнения Гельмгольца.
Для того, чтобы работа была max, она должна равняться тепловому эффекту Amax = Qv, надо вычислить:
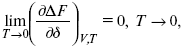
?F = Qv.
Аналитические выражения третьего закона термодинамики:
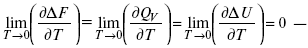
это изохорно-изотермические условия.
Если Аmax = QP, ?G, Qp, ?H – функции
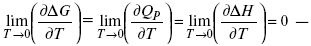
это изобарно-изотермические условия.
Тепловая теорема Нернста (третий закон термодинамики)(рис. 16)

Рис. 16
Энергии (?U, ?H, QV, QP, ?F, ?G), tg?угла наклона прямой – дает температурный коэффициент любой функции.
Для реакций, протекающих в конденсированных системах при приближении температуры к абсолютному нулю, кривые max работы и теплового эффекта соединяются и имеют одну большую касательную, параллельную оси температур.
Следствия из третьего закона термодинамики:
1. Свойства энтропии вблизи абсолютного нуля – постулат Планка:
?F = ?U – T?S.
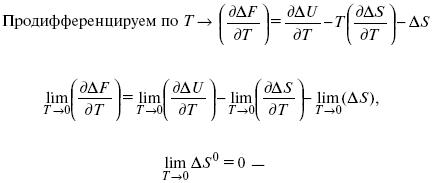
абсолютная энтропия.
2. Теплоемкость Сp, Сv
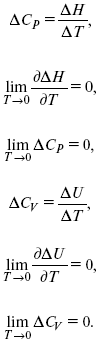
3. Коэффициент термического расширения тела и термического давления.
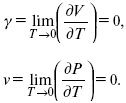
Идеальные газы не подчиняются третьему закону термодинамики, так как газ вблизи абсолютного нуля называется вырожденным.
CP – CV ? R вблизи абсолютного нуля – уравнение Майера не работает.
4. О невозможности достижения абсолютного нуля. Третий закон термодинамики – приближенный закон. Используется для совершенного кристалла любого вещества.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Глава 45 ПРИМЕРЫ ИЗ ТЕРМОДИНАМИКИ
Глава 45 ПРИМЕРЫ ИЗ ТЕРМОДИНАМИКИ § 1. Внутренняя энергия§ 2. Применения§ 3. Уравнение Клаузиуса –Клайперона§ 1. Внутренняя энергияКогда приходится использовать термодинамику для дела, то оказывается, что она очень трудный и сложный предмет. В этой книге, однако, мы не
Третий закон Ньютона
Третий закон Ньютона Ничто не может быть проще той мысли, которая положена в основу этого проекта — двигаться в пустых пространствах без всякой опоры. На первых же уроках физики мы узнаем закон „действия и противодействия" или „третий закон Ньютона": сила действующая
Возникновение и развитие термодинамики. Карно
Возникновение и развитие термодинамики. Карно Если в XVIII в. в физике (за исключением механики) господствовал эксперимент, так что физику определяли как науку «о всем том, что через опыты познать можно», то в XIX в. картина начинает меняться. Экспериментальная физика
Второе начало термодинамики
Второе начало термодинамики Прогресс теплотехники не только стимулировал открытие закона сохранения и превращения энергии, но и двинул вперед теоретическое изучение тепловых явлений. Уточнялись основные понятия, создавалась аксиоматика теории теплоты,
3. Первый закон термодинамики. Калорические коэффициенты. Связь между функциями CP и Cv
3. Первый закон термодинамики. Калорические коэффициенты. Связь между функциями CP и Cv Формулировки первого закона термодинамики.1. Общий запас энергии в изолированной системе остается постоянным.2. Разные формы энергии переходят друг в друга в строго эквивалентных
5. Процессы. Второй закон термодинамики
5. Процессы. Второй закон термодинамики Второй закон термодинамики, в отличие от первого закона термодинамики, изучает все процессы, которые протекают в природе, и эти процессы можно классифицировать следующим образом.Процессы бывают самопроизвольные,
ЛЕКЦИЯ № 3. Растворы
ЛЕКЦИЯ № 3. Растворы 1. Общая характеристика растворов Растворы – термодинамически устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это дисперсные системы, состоящие из дисперсной фазы и дисперсионной
ЛЕКЦИЯ № 4. Катализ
ЛЕКЦИЯ № 4. Катализ 1. История открытия явления катализа Катализ – изменение скорости химической реакции в присутствии катализаторов. Самые простые научные сведения о катализе были известны уже к началу XIX в. Знаменитый русский химик, академик К. С. Кирхгоф, открыл в 1811 г.
ЛЕКЦИЯ № 5. Химическое равновесие
ЛЕКЦИЯ № 5. Химическое равновесие 1. Понятие химического равновесия. Закон действующих масс При протекании химической реакции через некоторое время устанавливается химическое равновесие. Существует два признака химического равновесия: кинетический,
ЛЕКЦИЯ № 6. Химическая кинетика
ЛЕКЦИЯ № 6. Химическая кинетика 1. Понятие химической кинетики Кинетика – наука о скоростях химических реакций.Скорость химической реакции – число элементарных актов химического взаимодействия, протекающих в единицу времени в единицу объема (гомогенные) или на единице
ЛЕКЦИЯ № 9. Термохимия
ЛЕКЦИЯ № 9. Термохимия 1. Понятие термохимии Раздел физической химии и химической термодинамики, изучающий тепловые процессы теплоемкости веществ, называется термохимией.?Q = dU + ?A– первый закон термодинамики. ?Q – не является функцией состояния. P = const || V = const – функции
ЛЕКЦИЯ № 11. Электрохимия
ЛЕКЦИЯ № 11. Электрохимия 1. Понятие электрохимии Электрохимия – раздел физической химии, который рассматривает системы, содержащие ионы (растворы или расплавы электролитов) и процессы, протекающие на границе двух фаз с участием заряженных частиц.Первые представления о
ЛЕКЦИЯ № 12. Теоретическая электрохимия
ЛЕКЦИЯ № 12. Теоретическая электрохимия 1. Ассоциации в растворах электролитов. Понятие о теории сильных электролитов. Активность При увеличении концентрации растворов электролитов создаются условия, когда за счет электростатического взаимодействия становится
Глава третья. ИДЕЯ ppm-2 и ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Глава третья. ИДЕЯ ppm-2 и ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ У кого не уяснены принципы во всей логической полноте и последовательности, у того не только в голове сумбур, но и в делах чепуха. Н. Г.
25. Второе начало термодинамики. Энтропия
25. Второе начало термодинамики. Энтропия Существует несколько формулировок второго закона термодинамики: теплота сама собой не может переходить от тела с меньшей температурой к телу с большей температурой (формулировка Клаузиуса), или невозможен вечный двигатель