РЕЗЕРФОРД И ОТКРЫТИЕ АТОМНОГО ЯДРА
РЕЗЕРФОРД И ОТКРЫТИЕ АТОМНОГО ЯДРА
Что же происходило с тем, кто в молодости был хорошим игроком в регби, а затем раньше всех догадался, что атом может распадаться? Эрнест Резерфорд закончил свою американскую «ссылку» в январе 1907 года, через некоторое время после смерти Пьера. Хотя он получил щедрые предложения от престижных американских университетов, таких как Йель и Стэнфорд, он хотел вернуться в старую Европу, которая все еще была центром мировой науки. Возможность представилась, когда Манчестерский университет предложил Резерфорду кафедру физики: говорили, в Манчестере было лучшее физическое отделение в Великобритании — естественно, после Кавендиша в Кембридже.
Через год после прибытия в Манчестер Резерфорд вместе с Содди получил Нобелевскую премию за открытие процессов радиоактивного распада. Эта награда больше обеспокоила ученого, нежели обрадовала, поскольку ему присудили премию по химии, а он обычно говорил, что наука — это или физика, или коллекционирование марок. Много лет спустя ему по-прежнему нравилось смеяться над тем, что многие химики предпочитают эксперименты абстрактному мышлению, которое казалось делом исключительно физиков. Так, около 1930 года во время одного неформального разговора со студентами-химиками из Оксфордского университета в клубе «Алембик» он сказал: «Если бы вы, химики, меньше работали и больше думали, какие чудесные достижения мы бы наблюдали в вашей науке в ближайшие годы!»
Нобелевская премия не была для Резерфорда целью, скорее наоборот, она знаменовала продолжение еще более блестящей творческой деятельности. Когда ученый обосновался в Манчестере, то вместе с самыми талантливыми учениками, которые когда-либо были у преподавателя, он навсегда перевернул наше понимание материи.
В начале XIX века Джон Дальтон — он также преподавал в Манчестере математику и то, что тогда называли натурфилософией, — воскресил понятие атома, предложенное Демокритом в V веке до н.э., и определил его как наименьшую часть материи, сохраняющую ее свойства. В его модели атомы были твердыми, плотными и неделимыми шарами. Открытия конца XIX века, касающиеся электрической природы материи, сделали очевидным существование субатомных частиц, несущих заряд. После определения отношения заряд/масса электронов Дж. Дж. Томсон предложил свою модель пудинга, в которой почти вся масса и весь положительный заряд атома были распределены равномерно, в то время как отрицательные заряды были вкраплены в эту массу, как изюминки в пудинг. Эта модель считалась рабочей, но когда Резерфорд раскрыл природу радиоактивного распада, то а-частицы, умело использованные в качестве снарядов его учениками Гейгером и Марсденом, доказывали ее ошибочность. Резерфорд рассказывал на лекции, которую прочитал в Кембридже спустя много лет, в 1936 году:
«Я не думал, что ?-частицы могут быть рассеяны на большой угол, потому что мы знали, что они тяжелые и обладают большой энергией. […] Помню, через два или три дня Гейгер пришел очень возбужденный и сказал, что они «обнаружили несколько отраженных ?-частиц». Это был самый невероятный факт, который произошел в моей жизни. Настолько невероятный, как если бы при выстреле 15-дюймовым пушечным ядром в лист бумаги ядро бы срикошетило. Я понял, что это отражение, должно быть, является результатом уникального столкновения, и когда я сделал подсчеты, увидел: невозможно, чтобы имелось что-то величины такого порядка, если только речь идет не о системе, в которой большая часть массы сконцентрирована в крошечном ядре. Именно тогда мне пришла в голову идея об атоме с центром, массивным, крошечным и несущим заряд».
Распределение заряда и массы атома, которое представил себе Резерфорд в 1911 году, очень похоже на то, что мы знаем сегодня. Атом практически пуст, положительный заряд и большая часть массы концентрируются в крошечном ядре, которое находится в центре, в то время как электроны движутся по орбите вокруг него, образуя что-то вроде облака. Если представить, что весь атом, размер которого определяется электронными облаками, имеет размер, равный футбольному полю, то это ядро было бы диаметром с жемчужину. Все химические реакции — это всего лишь модификации распределения электронов, наиболее удаленных от ядра, как движение зрителей на самых верхних ступенях стадиона. Но, как это происходит и во время матча, когда вся публика сконцентрирована на том, что совершается в центре поля, как бы высоко ни находилось место, так и в атоме мельчайшие движения электронов в оболочке определяются взаимодействием с положительным зарядом ядра.
Противоречия планетарной модели атома Резерфорда, в которой электроны движутся по орбите вокруг ядра, как планеты вокруг Солнца, были сняты одним из его учеников, Нильсом Бором. Этот датский физик, адаптировав квантовую гипотезу Планка, заявил в 1913 году, что электроны стабильны на своих орбитах и не испускают энергию, в противоположность предсказанному классической физикой для заряженной частицы в круговом движении. Постулаты Бора не только делали жизнеспособной планетарную модель Резерфорда, но и объясняли многие предыдущие данные, особенно атомные спектры. В трудах Шрёдингера и Гейзенберга в конце 1920-х годов в итоге появилась квантовая модель атома. Вместе с этим важным теоретическим результатом в лаборатории Манчестера имела место экспериментальная разработка внешне небольшого масштаба, которая, однако, имела чрезвычайное значение: Гейгер разработал прибор, позволявший считать а-частицы по одной. Его счетчик стал необходимым инструментом для всех лабораторий, в которых изучали и изучают радиоактивность.
* * *
СЧЕТЧИК ГЕЙГЕРА
Когда думают о средах, загрязненных радиоактивностью, очень часто вспоминают особый звук, напоминающий стрекотание, — он ассоциируется со счетчиком Гейгера, обнаруживающим ?- и ?-частицы, возникающие в ядерных реакциях. Счетчиком воспользовалась Мария Кюри, когда ее дочь Ирен принесла радиоактивный алюминий — первый продукт с искусственной радиоактивностью. Аппарат был разработан в 1908 году Резерфордом и Гейгером, одним из его сотрудников в Манчестере. Резерфорд использовал ?-частицы как снаряды для определения природы радиоактивных процессов. Для их количественной оценки кто-то должен был считать следы, которые ?-частицы оставляли на флуоресцентном экране из сульфида цинка. Лучшим в этой задаче был Ханс Гейгер, который мог считать их часами, не допуская ошибок. Однако немецкий физик придумал устройство, освободившее его от этой изнурительной работы, — так возник первый прототип счетчика Гейгера, который затем улучшил ученик физика, Мюллер. Аппарат состоит из работающей как катод металлической трубки, наполненной инертным газом, таким как аргон; внутри нее проволока, которая работает как анод. У трубки должно быть окно, сделанное из очень тонкой пластинки, которое позволяло бы проникать радиации, но мешало бы выходу газа, обычно оно изготавливается из слюды или ПЭТ. Когда ионизационная радиация (?- или ?-частицы) воздействует на атом аргона, она забирает у него электрон, который из-за своего отрицательного заряда притягивается анодом, в то время как произведенный катион Ar+ притягивается катодом. Вследствие этого в счетчике создается небольшой ток, пропорциональный интенсивности радиации. Ток, порождаемый радиацией, вызывает ионизацию газа — тот же процесс Мария измеряла своими пьезоэлектрическими кварцевыми весами, но его количественная оценка намного проще.

Схема счетчика Гейгера
* * *
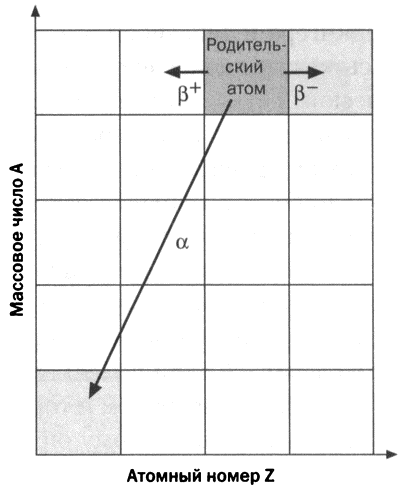
Параллельно была раскрыта другая загадка радиоактивности. При изучении элементов, производимых в рядах радиоактивного распада, Содди в 1910 году заметил, что элементы, которые он назвал мезоторием и торием-Х, как и радий, невозможно было выделить, поэтому он начал думать о том, могут ли одно место в периодической таблице делить несколько элементов. В 1913 году эта догадка подтвердилась, когда немецкий ученый Казимир Фаянс — также работавший в Манчестере с Резерфордом — пришел к такому же выводу. В законах Содди — Фаянса о радиоактивном распаде устанавливалось, что когда элемент испускает а-частицу, он смещается на две позиции влево по периодической таблице, а когда он испускает ?-частицу, он смещается на одну позицию вправо.
Содди выяснил, что если элемент испускает ?-частицу, а затем две ?-частицы, то получается не исходный элемент, а другое вещество с такими же химическими свойствами, но другим временем полураспада. При обсуждении этой видимой нестыковки во время семейного ужина шотландский врач Маргарет Тодд предложила Содди термин «изотоп» для обозначения веществ, которые занимают одно место в периодической таблице. Первый признак существования изотопов обнаружил Дж. Дж. Томсон, когда нашел две линии, приписываемые неону, в каналовых (анодных, или положительных) лучах.
Окончательное доказательство предоставил его ученик Фрэнсис Уильям Астон после возвращения с Первой мировой войны. С помощью масс-спектроскопии, которую открыл Томсон, Астон выделил два вида газа неона массой 20 и 22 и предложил свое правило целого числа, согласно которому элементы, атомная масса которых не является целым числом, имеют несколько изотопов в значимых пропорциях. Этому правилу подчиняется неон с атомной массой 20,2 — это промежуточное значение между атомной массой неона-20, относительная распространенность которого составляет 90,5%, и неона-22 с распространенностью 9,5%. Подобный же случай представляет и хлор, атомная масса которого 35,45 соответствует промежуточному значению между массой изотопа хлор-35 (76%) и хлор-37 (24%). В 1922 году Астон получил за свои исследования Нобелевскую премию по химии. Атомная масса перестала быть характерным свойством химического элемента, подтверждая зарождение химии невзвешиваемого, о которой говорила Мария Кюри.
* * *
ЗАКОНЫ СОДДИ-ФАЯНСА О РАДИОАКТИВНОМ РАСПАДЕ
Эти три закона были предложены Фредериком Содди и Казимиром Фаянсом независимо друг от друга в 1913 году.
1. Когда радиоактивный атом испускает ?-частицу, массовое число получившегося атома (А) уменьшается на 4 единицы, а атомный номер (Z) — на 2. Например,
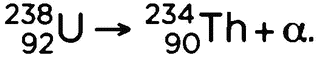
2. Когда радиоактивный атом испускает ?-частицу, атомный номер (Z) увеличивается (?-) или уменьшается (?+) на единицу, а массовое число (А) остается постоянным. Например,
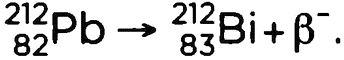
3. Когда возбужденное ядро испускает электромагнитную радиацию (?), не меняются ни А, ни Z, происходит только потеря энергии.
Сегодня известно, что ?-частица — это ядро атома гелия (следовательно, ее символ — 42Не), в то время как частицы ? и ?+ — электроны и позитроны соответственно.
* * *
Генри Мозли, еще один партнер Резерфорда в Манчестере, определил характерное свойство каждого элемента. Он измерил спектры излучения рентгеновских лучей всех известных в то время элементов и выяснил, что квадратный корень частоты испускаемых рентгеновских лучей пропорционален уникальной частоте для каждого элемента. Мозли определил эту величину как заряд центрального положительного ядра и назвал ее Z, что сегодня известно как атомный номер. Он опубликовал свои результаты в двух статьях, которые послал незадолго до того, как отправился на фронт. Работы увидели свет в 1913 и 1914 годах. Мозли так и не узнал, что именно в том году, когда он погиб на войне, в 1915-м, он стал бы одним из самых молодых кандидатов на Нобелевскую премию.
Ученый заметил: Z увеличивается в том же порядке, что и атомная масса, кроме таких элементов, как кобальт, никель, йод и теллур. Чему были обязаны эти исключения? Очевидно, существованию более тяжелых изотопов у элементов с меньшим атомным номером. Но почему существуют изотопы? Потому что у ядра есть, помимо протонов, еще одна частица, нейтрон, которая не была обнаружена, потому что у нее отсутствует заряд. Резерфорд догадался о существовании нейтрона еще в 1920 году, но только в 1932 году это экспериментально подтвердил другой его ученик, Джеймс Чедвик. Он сделал это, повторив эксперимент, который провели в Радиевом институте Ирен Кюри и ее супруг Фредерик Жолио-Кюри. Опыт заключался в том, чтобы бомбардировать бериллиевую пластинку ?-частицами, что вызвало испускание лучей, которые исследователи посчитали у-лучами высокой энергии, порожденными протонами при прохождении через парафин. Резерфорд подверг сомнению эти результаты; Чедвик поверил в их наличие, но не в толкование. Зная, что нужно искать, и пользуясь подходящим детектором, Чедвик обнаружил нейтрон и получил за это в 1935 году Нобелевскую премию по физике. Так была окончательно решена загадка структуры атома.
* * *
НАСЛЕДИЕ МОЗЛИ
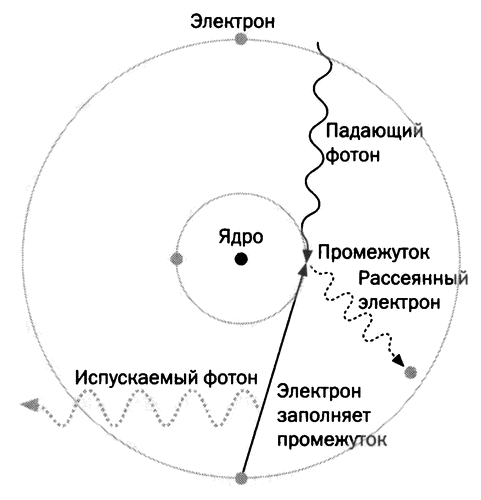
После того как стало известно о дифракции, обнаруженной фон Лауз и Брэггом, Генри Мозли (1887–1915) поехал в лабораторию Брэгга в Лидском университете, потому что хотел больше узнать о взаимодействии рентгеновских лучей с материей. Ознакомившись с источниками рентгеновских лучей, он исследовал их энергию, используя в качестве анодов все 73 химических элемента, известных к тому времени. Он обнаружил линейную связь между длиной волны испускаемых каждым элементом лучей и характерной величиной, которую Мозли определил как ядерный заряд. На основе этих значений он установил новый порядок элементов в периодической таблице, исправив исходный порядок Менделеева на основе значений атомной массы и предсказав существование еще не открытых элементов. Ход эксперимента Мозли схематично показан на рисунке, где приведена схема атома по модели Бора, которая, в свою очередь, основывается на модели Резерфорда: падающий фотон (верхняя волнистая линия) выбивает электрон (правая волнистая линия) из внутренних слоев электронной оболочки. Промежуток заполняется электроном из внешних слоев, который, в свою очередь, испускает другой фотон с энергией (левая волнистая линия), равной разнице между двумя этими уровнями. Каждый химический элемент испускает фотон с характерной энергией, пропорциональной числу протонов ядра. Энергия фотонов порождает флуоресцентные линии рентгеновских лучей, которые помогли Мозли определить атомный номер, Z. Этот процесс — основа одного из самых чувствительных методов недеструктивного химического анализа, флуоресценции рентгеновских лучей. Мозли провел первую часть своего исследования в лабораториях Резерфорда в Манчестере, а последнюю часть — в Кларендонской лаборатории в Оксфорде, где не было даже электрической сети и приходилось покрывать расходы самому. Официально он оставил Манчестер, чтобы вернуться к матери в Оксфорд, но самое главное — он хотел выйти из тени профессора и плеяды его блистательных учеников, которые могли затмить его собственную работу.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Строение ядра
Строение ядра Хотя вопрос об излучении ?-частицы казался окончательно выясненным, поскольку закон сохранения электрического заряда выполнялся, физики продолжали свои исследования. Для них оставалось загадкой, как положительно заряженное ядро способно испускать
Отталкивание внутри ядра
Отталкивание внутри ядра К 1932 году стало ясно, что ядра состоят исключительно из протонов и нейтронов. От более ранних теорий, которые утверждали, что в ядре находятся электроны, отказались. Хотя это решило сразу много проблем, возник вопрос, которого не было раньше.До сих
Притяжение внутри ядра
Притяжение внутри ядра Если при рассмотрении атомных ядер пренебречь гравитационными взаимодействиями и учитывать только электромагнитные, трудно объяснить существование ядра. Частицы, из которых оно состоит, не могли бы соединиться из-за колоссальных сил
Внутри ядра
Внутри ядра Это небывалое путешествие пройдет для пассажиров Жюль-Вернова ядра далеко не так мирно и благополучно, как описано в романе. Не думайте, однако, что опасность грозит им во время путешествия от Земли до Луны. Ничуть! Если бы им удалось остаться живыми к моменту,
Открытие атомного ядра
Открытие атомного ядра Рассмотрим несколько подробнее одно из фундаментальных открытий Резерфорда —открытие атомного ядра и планетарной модели атома. Мы видели, что уподобление атома планетной системе делалось еще в самом начале XX в. Но эту модель было трудно
Расщепление ядра
Расщепление ядра Открытие изотопов стабильных элементов, уточнение измерений элементарного заряда были первыми достижениями послевоенной физики (1917-1918). В 1919 г. было сделано новое сенсационное открытие — искусственное расщепление ядра. Открытие это было сделано
Против атомного шантажа
Против атомного шантажа Президент Рузвельт, давший указание на развёртывание работ по созданию атомного оружия, не дожил до конца войны. Его место в Белом доме занял Гарри Трумэн. Новый президент, говорят, не знал о ведущихся работах, и военное министерство не торопилось
Удивительный мир внутри атомного ядра
Удивительный мир внутри атомного ядра
Глава 12 Внутри ядра
Глава 12 Внутри ядра Следующая лекция, которую посетил мистер Томпкинс, была посвящена внутреннему строению ядра как центра, вокруг которого вращаются атомные электроны.— Леди и джентльмены, — начал профессор. — Все более углубляясь в строение материи, мы попытаемся
4.2. Физические характеристики, строение ядра
4.2. Физические характеристики, строение ядра В последнее десятилетие наши знания о кометах и о процессах, происходящих на них, значительно расширились. Резкому повышению интереса к кометам способствовали подготовка и проведение международного космического
Глава 3 Кентавры атомного мира
Глава 3 Кентавры атомного мира Теория на перепутье«Победителей не судят!» — гласит старая поговорка. В науку она, однако, доступа не имеет. Еще как пристрастно судят! Пока не обоснован каждый шаг ученого в его сражении с природой, победа не засчитывается.Но изредка бывает
Резерфорд и планетарный атом
Резерфорд и планетарный атом Эрнст Резерфорд (1871—1937) родился в маленьком городке Южного острова Новой Зеландии в семье выходца из Шотландии. Его мать была школьной учительницей и великолепно играла на рояле, что было необычным в Новой Зеландии того времени. Его отец,