Резерфорд и планетарный атом
Резерфорд и планетарный атом
Эрнст Резерфорд (1871—1937) родился в маленьком городке Южного острова Новой Зеландии в семье выходца из Шотландии. Его мать была школьной учительницей и великолепно играла на рояле, что было необычным в Новой Зеландии того времени. Его отец, энергичный и умелый фермер, организовал выгодный бизнес по производству веревок и канатов. Многочисленная семья молодого Эрнста жила вдали от больших городов на семейной ферме.
В 10 лет Эрнст прочел популярную книгу по физике и, как это случалось с другими физиками в подобных случаях, был увлечен ею. После школы второй ступени и колледжа, где он был первым на экзаменах по английскому языку, латыни, истории, математике, физике и химии, в 1889 г. получил стипендию университета Новой Зеландии. Там он получил ученую степень, представив диссертацию по магнетизму железа, получаемого при высокочастотных электрических разрядах. В 1894 г. он выиграл стипендию, которая позволяла ему продолжить занятия в Англии. История гласит, что он получил эту новость во время выкапывания картошки и воскликнул: «Это последняя картошка, которую я выкапываю в моей жизни»; после чего одолжил деньги на билет и отправился в 1895 г. в Кембридж, куда был принят студентом-исследователем в знаменитую Кавендишскую лабораторию, возглавляемую Дж. Дж. Томсоном, открывателем электрона.
Как раз до этого Кембриджский университет решил больше сосредоточиться на экспериментальных исследованиях, открывая лаборатории и для студентов из других университетах, среди которых первым был Резерфорд. Он быстро стал известен среди других соучеников, один из которых писал: «У нас здесь появился кролик от Антиподов, и он копает очень глубоко».
В Кембридже Резерфорд продолжил свои исследования магнетизма и получил интересные результаты по передаче и детектированию электромагнитных волн. Затем, после открытия (в 1895 г.) В. Рентгеном рентгеновских лучей, Резерфорд, с энтузиазмом и энергией, которые были отличительными чертами его характера, присоединился к Томсону в его исследованиях рентгеновских лучей, а позднее (1896 г.) радиоактивности. В эту область он внес фундаментальные вклады, работая сначала в Кембридже, а после 1898 г. в Монреале (Канада), где он был назначен профессором физики в университете МакГилла. Он выдвинул идею, что радиоактивность заключается в разрушении первоначальных атомов с превращением их в другие элементы. С помощью этой теории дезинтеграции он раскрыл природу явлений радиоактивности. Эта теория получила полное подтверждение экспериментами, которые он выполнил вместе с молодым сотрудником, химиком Фредериком Содди (1877-1956), который получил Нобелевскую премию по химии в 1921 г. «за его вклад в наши знания химии радиоактивных веществ и его исследования происхождения и природы изотопов». Эти эксперименты включали изучение природы излучений, испускаемых радиоактивными веществами, которые открыл Резерфорд и обозначил их как альфа- и бета-лучи (ядра гелия — альфа, электроны — бета). В 1907 г. Резерфорд возвратился в Великобританию в качестве профессора физики в Манчестере (занял эту позицию после Артура Шустера). В следующем году он получил Нобелевскую премию по химии «за его исследования по дезинтеграции элементов и химию радиоактивных веществ». Наконец, в 1911 г. в результате изучения рассеяния альфа-частиц в твердотельных мишенях он предложил планетарную интерпретацию атома. В 1919 г. он объявил о первом искусственном развале атомного ядра и занял после Дж. Дж. Томсона пост директора Кавендишской лаборатории. В 1914 г. он был возведен в рыцарское звание, в 1932 г. удостоился титула Барона Резерфорда Нельсона. В 1925— 1930 гг. он был президентом Королевского общества.
Когда он неожиданно умер от ущемления грыжи, его прах был похоронен в Вестминстерском Аббатстве, к востоку от захоронения Ньютона и рядом с лордом Кельвином, в присутствии короля и представителей правительства.
Резерфорд, который считается выдающейся фигурой в развитии физики, был человеком вулканической энергии, огромного энтузиазма, исключительной работоспособности и твердого здравого смысла. Один из его сотрудников сказал, что он является человеком «не симпатичным, но просто великим». Фальшивая скромность была неведома ему.
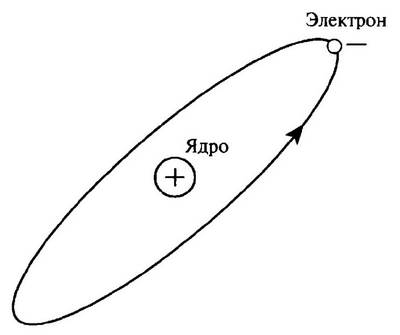
Рис. 16. Рисунок атома Резерфорда. Пример в отношении водорода. Электрон (отрицательный заряд) вращается вокруг ядра (положительный заряд) подобно вращению Земли вокруг Солнца
В 1911 г. он постулировал модель атома, в которой было, наконец, дано правильное распределение отрицательных (электронов) и положительных зарядов. С помощью эксперимента, который стал классическим в истории физики, он продемонстрировал, что сильная концентрация положительного заряда помещается в центральной области каждого атома, в которой также сосредоточена большая часть массы атома. Эта центральная часть, которая по размерам, по крайней мере, в 100 000 раз меньше, чем весь атом, и в настоящее время обозначается как атомное ядро. Отрицательный заряд, которым окружается ядро, образуется электронами, которые вращаются вокруг ядра под действием сил электрического взаимодействия. Поскольку атом в целом электрически нейтрален, общий заряд электронов, вращающихся вокруг ядра, должен быть равен положительному заряду ядра (рис. 16).
Атомы различных элементов содержат разное число электронов, вращающихся вокруг ядра. К этому заключению пришли последовательно, отталкиваясь от открытия Менделеевым: химические элементы можно расположить в последовательности с прогрессивно увеличивающимися атомными весами в таблице Менделеева так, что элементы со сходными химическими свойствами располагаются в одной определенной колонке. Позднее (1913 г.) английский физик Генри Г. Дж. Мозли (1887-1915), который погиб молодым в Галлиполи во время Первой мировой войны, выполнил серию экспериментов по рассеянию атомами рентгеновских лучей. Эти эксперименты позволили ему определить число электронов, которые содержит атом. Он показал, что перемещение одного элемента до другого соседнего в таблице Менделеева получается путем добавления электрона. Таким образом, было установлено, что число электронов в атоме конечно и много меньше, чем воображали. Водород является простейшим атомом с одним электроном, гелий имеет два, и т.д. вплоть до самого тяжелого элемента — урана, известного в то время, который содержит 92 электрона (сегодня искусственно создают атомы с числом электронов до 118).
Мы можем сказать, что эта модель атома подобна системе планет, вращающихся вокруг Солнца под действием сил всемирного тяготения, с важным отличием, которым нельзя пренебрегать. Электроны, которые вращаются вокруг ядра, несут электрический заряд и поэтому должны, согласно законам электромагнетизма Максвелла, испускать электромагнитные волны подобно антенне радиовещательной станции. Но поскольку эти «атомные антенны» много меньше, электромагнитные волны, испускаемые атомами, в миллиарды раз меньше тех, что испускаются обычной антенной. Эти волны лежат в видимом диапазоне, и их испускание делает тела светящимися.
Таким образом, согласно модели Резерфорда, электроны, которые вращаются вокруг ядра, должны испускать световые волны, и поскольку эти волны несут энергию, электроны будут терять свою кинетическую энергию из-за испускания ими излучения. Легко рассчитать, что если это так, то все электроны атома полностью потеряют свою кинетическую энергию за пренебрежимо малую долю секунды и должны упасть на поверхность ядра.
Однако наблюдения показывают, что это не так, и атомные электроны бесконечно долго вращаются вокруг ядра на относительно большом расстоянии от них. Вдобавок к этому противоречию с фундаментальной природой атома, имеется ряд других несоответствий между теоретическими предсказаниями и экспериментальными результатами. Например, опыт говорит, что атомы излучают свет только определенных цветов или длин волн (спектральные линии, которые обсуждались в главе 2), в то время как движение электрона в модели Резерфорда должно приводить к излучению всех цветов (т.е. всех длин волн).
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Глава VI. Атом Бора
Глава VI. Атом Бора 1. Спектры и спектральные линии Невозможно непосредственно изучать внутреннее строение атома, этого микромира невообразимо малых размеров, характеризуемого процессами, недоступными нашему прямому восприятию. Структура атома проявляется только
Атом, который построил бор
Атом, который построил бор Вольный перевод В. Турчина. Вот атом, который построил Бор. Это – протон, Который в центр помещен Атома, который построил Бор. А вот электрон, Который стремглав облетает протон, Который в центр помещен Атома, который построил Бор. Вот
Глава 4. Квантовый атом
Глава 4. Квантовый атом Первое августа 1912 года, четверг. Улицы Слагелсе, небольшого живописного городка примерно в пятидесяти милях к юго-западу от Копенгагена, украшены флагами. Начальник полиции (мэр был в отпуске) за две минуты обвенчал в ратуше Нильса Бора и Маргрет
Глава пятая. Атом Резерфорда-Бора
Глава пятая. Атом Резерфорда-Бора Модели атома до Бора Развитие исследований радиоактивного излучения, с одной стороны, и квантовой теории — с другой, привели к созданию квантовой модели атома Резерфорда — Бора. Но созданию этой модели предшествовали попытки построить
Атом Бора
Атом Бора Вернемся, однако, к работам Бора о строении атомов. Бор, как и Томсон до него, ищет такое расположение электронов в атоме, которое объяснило бы его физические и химические свойства. Бор уже знает о модели Резер-форда и берет ее за основу. Ему известно также, что
И снова таинственный атом
И снова таинственный атом Полная картина влияния состава веществ на их свойства прояснится, писал М.Ломоносов, «не раньше, чем будет определено число химических элементов и будет точно изучена химическая природа их». Пока же, как мы видим у Лавуазье, в ряду химических
Атом, который понял Бор
Атом, который понял Бор Впрочем, ядерную историю можно начинать и с 1896 года, когда счастливый случай помог открыть радиоактивность урана. А чтобы понять, как интересно было тогда физикам, напомню, что само слово «радиоактивность» появилось лишь два года спустя, после
Атом, который построил Бор
Атом, который построил Бор Вольный перевод В. Турчина Вот атом, который построил Бор. Это – протон. Который в центр помещен Атома, который построил Бор. А вот электрон. Который стремглав облетает протон. Который в центр помещен Атома, который построил Бор. Вот
Глава 1 Вторжение в атом
Глава 1 Вторжение в атом Благодарность… лягушкеВ Колтушах — маленьком городке под Ленинградом — стоит памятник собаке. Безымянной и бесконечно терпеливой собаке, которая помогла понять человеку, как он воспринимает окружающий мир.Памятника лягушке нет нигде.
Атом Бора и Резерфорда
Атом Бора и Резерфорда За год до прибытия Бора в Англию Резерфорд сделал открытие атомного ядра, и осенью 1911 г. эти два человека встретились и, несомненно, понравились друг другу. Поэтому в марте 1912 г. Бор отправился из Кембриджа в Манчестер с намерением проводить
РЕЗЕРФОРД И ОТКРЫТИЕ АТОМНОГО ЯДРА
РЕЗЕРФОРД И ОТКРЫТИЕ АТОМНОГО ЯДРА Что же происходило с тем, кто в молодости был хорошим игроком в регби, а затем раньше всех догадался, что атом может распадаться? Эрнест Резерфорд закончил свою американскую «ссылку» в январе 1907 года, через некоторое время после смерти