3. Первый закон термодинамики. Калорические коэффициенты. Связь между функциями CP и Cv
3. Первый закон термодинамики. Калорические коэффициенты. Связь между функциями CP и Cv
Формулировки первого закона термодинамики.
1. Общий запас энергии в изолированной системе остается постоянным.
2. Разные формы энергии переходят друг в друга в строго эквивалентных количествах.
3. Невозможно построить вечный двигатель первого рода, который бы давал механическую энергию, не затрачивая на это определенное количество молекулярной энергии.
4. Количество теплоты, подводимое к системе, расходуется на изменение Uвн и совершаемую работу.
5. Uвн– функция состояния, т. е. она не зависит от пути процесса, а зависит от начального и конечного состояния системы.
Доказательство:
Пусть ТДС рассматривается при двух параметрах давления и объема, имеется два состояния системы I и II. Нужно перевести систему из состояния I в состояние II либо по пути А, либо по пути В (рис. 3).
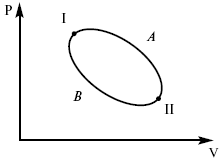
Рис. 3
Предположим, что по пути А изменение энергии будет ?UA, а по пути В – ?UB. Внутренняя энергия зависит от пути процесса
?UA = ?UB,
?UA – ?UB ? 0.
Согласно пункту 1 из формулировок первого закона термодинамики, общий запас энергии в изолированной системе остается постоянным
?UA = ?UB ,
Uвн – функция состояния не зависит от пути процесса, а зависит от состояния системы I или II. Uвн – функция состояния, является полным дифференциалом
Q = ?U + А –
интегральная форма уравнения первого закона термодинамики.
?Q = dU + ?A–
для бесконечно малого процесса, ?A– сумма всех элементарных работ.
Калорические коэффициенты
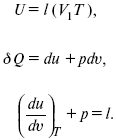
Теплота изотермического расширения:

Уравнение первого закона термодинамики в калорических коэффициентах
?Q = ldv + CvdT,
где l– коэффициент изотермического расширения;
Сv– теплоемкость при постоянном объеме.
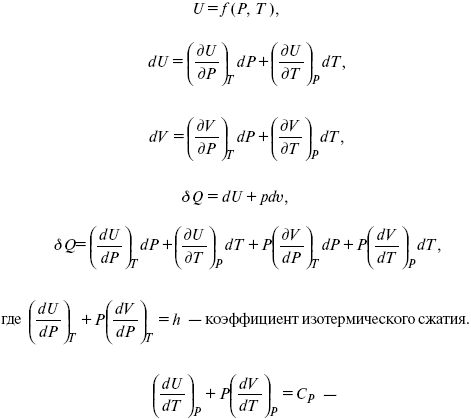
теплоемкость при const давлении,
?Q = hdp + СpdT,
?Q = ?dP + ?pdv.
Связь между функциями CP и Cv
?Q = hdp + СpdT = ldv + CvdT,
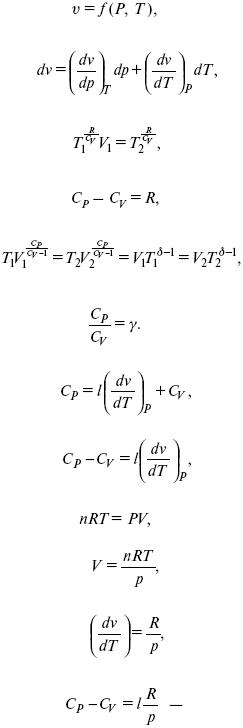
для реального газа.
Для идеального газа l= р
Ср– СV= R,
к = (?Q/дv)?– теплота изохорного расширения;
m = (?Q/дP)v– теплота изобарного сжатия.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Глава 45 ПРИМЕРЫ ИЗ ТЕРМОДИНАМИКИ
Глава 45 ПРИМЕРЫ ИЗ ТЕРМОДИНАМИКИ § 1. Внутренняя энергия§ 2. Применения§ 3. Уравнение Клаузиуса –Клайперона§ 1. Внутренняя энергияКогда приходится использовать термодинамику для дела, то оказывается, что она очень трудный и сложный предмет. В этой книге, однако, мы не
II — СВЯЗЬ МЕЖДУ НЕПРОНИЦАЕМОСТЬ Ю И ПЛОТНОСТЬ Ю
II — СВЯЗЬ МЕЖДУ НЕПРОНИЦАЕМОСТЬ Ю И ПЛОТНОСТЬ Ю Рентген указывал на то, что непроницаемость тела для лучей тем выше, чем выше его плотность, что подтвердило последующее исследование. Это важное обстоятельство можно убедительно объяснить единственным и никаким иным
Глава 4. Связь массы и энергии
Глава 4. Связь массы и энергии Несохранение массы Новое представление о строении атома укрепило уверенность физиков в том, что законы сохранения применимы не только к окружающему нас повседневному миру, но и к тому огромному миру, который изучают астрономы. Но
Возникновение и развитие термодинамики. Карно
Возникновение и развитие термодинамики. Карно Если в XVIII в. в физике (за исключением механики) господствовал эксперимент, так что физику определяли как науку «о всем том, что через опыты познать можно», то в XIX в. картина начинает меняться. Экспериментальная физика
Второе начало термодинамики
Второе начало термодинамики Прогресс теплотехники не только стимулировал открытие закона сохранения и превращения энергии, но и двинул вперед теоретическое изучение тепловых явлений. Уточнялись основные понятия, создавалась аксиоматика теории теплоты,
Наблюдения Сириуса и его связь с календарем.
Наблюдения Сириуса и его связь с календарем. Наблюдения Сириуса играли особую роль в истории древнеегипетского календаря. Наиболее ранние свидетельства о них восходят ко времени I династии (начало III тыс. до н. э.). Сохранилась табличка из слоновой кости, датируемая этим
5. Процессы. Второй закон термодинамики
5. Процессы. Второй закон термодинамики Второй закон термодинамики, в отличие от первого закона термодинамики, изучает все процессы, которые протекают в природе, и эти процессы можно классифицировать следующим образом.Процессы бывают самопроизвольные,
ЛЕКЦИЯ № 15. Третий закон термодинамики
ЛЕКЦИЯ № 15. Третий закон термодинамики Понятие химического сродства. Известно, что многие вещества реагируют друг с другом легко и быстро, другие вещества реагируют с трудом, а третьи – не реагируют. Исходя из этого, вывели предположение, что между веществами существует
Глава третья. ИДЕЯ ppm-2 и ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Глава третья. ИДЕЯ ppm-2 и ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ У кого не уяснены принципы во всей логической полноте и последовательности, у того не только в голове сумбур, но и в делах чепуха. Н. Г.
25. Второе начало термодинамики. Энтропия
25. Второе начало термодинамики. Энтропия Существует несколько формулировок второго закона термодинамики: теплота сама собой не может переходить от тела с меньшей температурой к телу с большей температурой (формулировка Клаузиуса), или невозможен вечный двигатель
2.3. Связь и различия между малыми телами
2.3. Связь и различия между малыми телами Порой в великой книге тайн природы Мне удается кое-что прочесть. У. Шекспир. «Антоний и Клеопатра» Как было отмечено ранее, согласно общепринятой гипотезе, кометы являются остатками протопланетного вещества, не вошедшего в
Оптические волокна и лазерная связь
Оптические волокна и лазерная связь Со времен античности свет использовался для передачи сообщений. В Китае, Египте, и в Греции использовали днем дым, а ночь огонь для передачи сигналов. Среди первых исторических свидетельств оптической связи мы можем вспомнить осаду