ГЛАВА 8 Обмен веществ, яды и противоядия
Из предыдущих глав можно было видеть, что большинство ядов прямо или опосредованно нарушают функции ферментно-медиаторных систем организма. В свою очередь и противоядия только тогда могут считаться действенными, когда они нормализуют эти нарушения. Иными словами, в той мере, в какой обменные процессы изменяются под влиянием ядов, они могут стать и объектом воздействия противоядий. В этой связи достаточно, например, вспомнить активное вмешательство в обмен веществ таких ядов и антидотов, — как мышьяк и унитиол, — свинец и комплексоны. Ряд ядов и противоядий заслуживает отдельного рассмотрения из-за особенностей их превращений в организме. Если биохимический механизм изменения структуры яда и какого-то другого вещества сходны, то такое вещество при определенных условиях может затормозить или снизить отравляющее действие яда. Это видно на примере метилового спирта — сильного общетоксического яда, который достаточно широко применяется в органическом синтезе и как растворитель. Сходство его органолептических свойств с этиловым спиртом нередко приводит к использованию метилового спирта с целью алкогольного опьянения. Уже в дозе 100–150 мл метиловый спирт вызывает ряд тяжелых расстройств, среди которых особое место занимает слепота. В организме он трансформируется в основном за счет реакций окисления с участием фермента алкогольдегидрогеназы, но некоторую роль играет и конъюгация с глюкуроновой кислотой. Особое значение для понимания механизма действия этого яда играют его метаболиты (продукты биотрансформации): формальдегид и муравьиная кислота. Именно эти вещества, прежде всего муравьиная кислота, а не сам метиловый спирт определяют развитие наиболее грозных симптомов отравления. Оказалось, что биотрансформация этилового (винного) спирта катализируется в основном тем же ферментом, который окисляет и метиловый спирт, т. е. алкогольдегидрогеназой (рис. 19). Таким образом, окисление обоих спиртов в организме идет по конкурентному типу, а этиловый спирт, введенный отравленному метиловым спиртом, увеличивает долю выведения последнего из организма в неизмененном, т. е. практически безопасном, виде и тем самым тормозит токсический процесс. При этом четкий антидотный эффект достигается внутривенными вливаниями 5%-ного раствора этилового спирта и назначением его внутрь в виде 20 %-ного раствора.[203] Любопытно, что лечебное действие известного противоалкогольного препарата антабуса (тетурама) заключается в ингибировании алкогольдегидрогеназы. Этиловый алкоголь, как видно из рис. 19, в процессе превра щений проходит через фазу ацетальдегида, который обычно быстро окисляется в уксусную кислоту. Антабус, блокируя фермент, задерживает эту реакцию, приводя после приема алкоголя к значительному увеличению концентрации ацетальдегида в крови и к появлению комплекса отрицательных вегетативных реакций. В одной из своих работ профессор Ж. И. Абрамова обратила внимание на то, что чем меньше различия в химической структуре обоих комбинирующихся в организме веществ, «тем больше вероятность их общего пути биотранcформации, а следовательно, и возможность конкурентных взаимоотношений по отношению к окислительным и другим энзимам».[204] Основываясь на собственных данных, полученных в опытах па нескольких видах животных, автор указывает на защитный эффект этилового спирта нем отравлении этиленгликолем (двухатомным спортом) и фторэтанолом. Тем самым тормозится окисление этих спиртов в высокотоксичные метаболиты — щавелевую и фторуксусную кислоты.
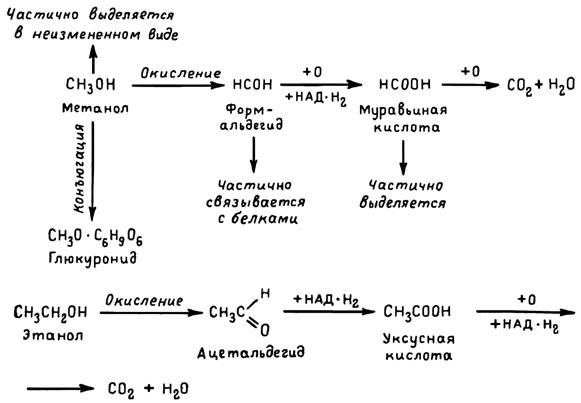
Рис. 19. Биотрансформация метилового и этилового спиртов. НАД — никотинамидадениндинуклеотид, кофермент дегидрогеназы, обеспечивающий перенос водорода при окислительно-восстановительных реакциях
Вмешательство в биохимические процессы обмена ядовитых веществ возможно и с помощью ферментных препаратов заместительного действия. Здесь в первую очередь надо вспомнить те ферменты, ингибирование которых при отравлениях определяет существо механизма действия ядов. Мы уже имели возможность убедиться, что введение в организм отравленного препаратов, включающих каталитически активные компоненты ферментов (моноаминоксидазы, пируватоксидазы), является весьма действенным лечебным приемом. В связи с этим несомненный антидотный интерес представляют препараты, включающие целые молекулы ингибируемых ферментов. Одна из первых попыток в данном направлении связана с холинэстеразой, очищенный препарат которой был предложен еще в 1952 г. шведским ученым Аугустинссоном для борьбы с отравлением ФОС. В 1961 г. в США специалисты одной исследовательской лаборатории пришли к выводу о возможности использования электрических угрей как источника холинэстеразы. Оказалось, что в организме этих рыб содержится весьма большое количество фермента. В 1970 г. сотрудниками Института эволюционной физиологии и биохимии им. И. М. Сеченова (г. Ленинград) был разработан метод получения холинэстеразы из эритроцитов крови быка. Тогда же была налажена технология ее промышленного получения с учетом возможного использования в клинике. Надо, однако, иметь в виду, что, кок и любой другой ферментный белок, холинэстераза слабо проникает в ткани нервной системы, с это, естественно, снижает ее лечебное действие.
Если фермент ускоряет обезвреживание яде, то дополнительное его впадение в организм должно затормозить течение интоксикации. Таким действием, к примеру, обладает роданаза. Было доказано,[205] что на фоне цианидного отравления этот фермент значительно усиливает дезинтоксикационное роданообразование тиосульфатом натрия и другими донаторами серы.
Иное использование ферментов при интоксикациях связано с их способностью вступать в конкурентные отношения с той или иной биоструктурой за связь с ядом или же непосредственно взаимодействовать с его молекулами. Тем самым ферментный препарат как бы принимает удар на себя. Данный механизм защитного действия можно видеть на примере использования протеолитических, т. е. расщепляющих белки, ферментов — химотрипсина и трипсина — при отравлениях ФОС. Установлено, что эти ферменты очень чувствительны к фосфорорганическим ингибиторам и вступают с ними, подобно холинэстеразе, в реакцию фосфорилирования.[206] Несомненный интерес в связи с этим представляют результаты экспериментального исследования, показавшего, что панкреатин (препарат, содержащий трипсин и амилазу, — пищеварительные ферменты поджелудочной железы) обладает выраженными антидотными свойствами по отношению к ряду высокотоксичных ФОС (октаметилу, хлорофосу и др.).[207] На основании этих данных таблетки панкреатина по 0,2–0,5 г и аэрозоли трипсина предлагается использовать в качестве специфического средства профилактики профессиональных отравлений ФОС. Наряду с другими антидотами некоторые авторы рекомендуют применять их также и при появлении признаков интоксикации.
Как уже указывалось, окись углерода имеет особое сродство к ферропротеидам, содержащим двухвалентное железо, в тем числе и к дыхательным ферментам — цитохромам. Отсюда практическая ценность полученного в лаборатории профессора Л. А. Тиунова доказательства антидотных свойств цитохрома С при отравлении окисью углерода.[208] В чистом виде цитохром С впервые был выделен в 1935 г. из сердечной мышцы быка. Из 100 кг сердечной мышцы удалось получить 1 г цитохрома. Интересно отметить, что содержание железа в этом препарате (0,34%) было таким же, как и в гемоглобине.[209] Предполагалось, что антидотное действие цитохрома С является следствием насыщения организма железом, содержащимся в этом препарате. Однако исследования итальянских ученых, проведенные в 1957–1959 гг., показали, что железо выполняет защитную роль при отравлении СО в дозировках, превышающих в пересчете на содержание Fe2+ в 30 раз лечебные дозы цитохрома С. К тому же было установлено, что поступающий извне цитохром выводится из организма в неизмененном виде. Тем самым, по-видимому, подтверждается мысль о заместительном лечебном действии этого фермента тканевого дыхания.[210]
При прослеживании судьбы многих ядов в организме возникло предположение о возможности направленного воздействия на процессы их метаболизма с целью снижения токсичности. Как было показано многочисленными экспериментами на животных, прежде всего это достигается усилением или ослаблением активности ферментов, ответственных за ход реакций биотрансформации ядовитых веществ. Тем самым применение химических соединений, вмешивающихся в процессы превращения ядов в организме, становится новым и многообещающим направлением антидотного воздействия на течение отравлений. Естественно, что если фермент ускоряет обезвреживание яда, то усиление его активности должно способствовать торможению токсического процесса. И наоборот, в тех случаях, когда токсичность яда увеличивается при его биотрансформации, эта же цель может быть достигнута ослаблением функции соответствующего фермента. В настоящее время известно немало как природных, так и синтетических соединений — активаторов и ингибиторов ферментов, метаболизирующих токсические вещества. К примеру, алдрин и некоторые другие хлорированные углеводороды активируют эетеразы — ферменты, гидролизующие ФОС, что усиливает процесс детоксикации последних. Поэтому введение животным алдрина способствует их выживанию при отравлении фосфорорганическими ядами. Опытным путем было также установлено, что активатором оксидазы, катализирующей окисление барбитуратов в организме, является гексахлорциклогексан, благодаря чему он защищает животных от отравляющего действия больших доз снотворных.
В других экспериментах была показана практическая значимость воздействия на метаболизм некоторых промышленных ядов биологических антиоксидантов. Так, токсическое действие бензола, которое связывается с продуктами его окисления — фенолами и полифенолами,[211] может быть резко ослаблено с помощью таких антиоксидантов, как метионин, цистин, цистеамин. Эти серосодержащие соединения угнетают оксидазы, окисляющие бензол в названные опасные для организма метаболиты. И наоборот: на фоне введения животным тиреодина — производного гормона щитовидной железы, повышающего окислительные процессы, отравляющее действие бензола усиливалось. С другой стороны, некоторые анти-оксиданты могут усиливать действие ферментов, катализирующих превращения ядов в организме. Так, цистеин и унитиол оказались эффективными активаторами роданазы. И. П. Лапин в лаборатории профессора В. М. Карасика показал, что эти вещества значительно ускоряют образование роданидов в клетках печени и тем способствуют выживанию экспериментальных животных при тяжелом отравлении цианидом натрия.[212] Активирующее действие цистеина и унитиола, вероятно, зависит от наличия в их молекулах SH-групп.
Более 10 лет назад известным канадским ученым Селье[213] при ряде отравлений были установлены защитные свойства сивронолактона (синонимы — альдактон, верошпирон):
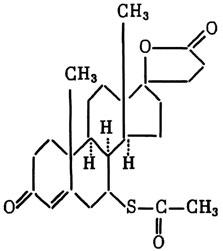
Данный лекарственный препарат, обладающий диуретическим (мочегонным) действием, является антагонистом альдостерона — гормона коры надпочечников. Оказалось, что антидотный эффект спиронолактона отчетливо выражен при интоксикациях такими лекарственными веществами, как дигитоксин, метацил, новокаин. Кроме того, спиронолактон надежно предотвращал у животных развитие отравления сулемой. Эти результаты наблюдались главным образом при предварительном (незадолго до отравления) введении спиронолактона в организм. Основываясь на своих исследованиях, автор приходит к выводу, что это действие спиронолактона есть следствие его стимулирующего влияния на некоторые микросомальные ферменты клеток печени. Одновременно такой детоксикационный эффект связывается с наличием в молекуле спиронолактона тиоацетатной группы, а также с его способностью активировать синтез сульфгидрильных групп биомолекул и проявлять свойства антиоксиданта в процессах биотрансформации чужеродных веществ.
Но, пожалуй, самым интересным, — самым ценным веществом, способным активно вмешиваться в процессы биотрансформации, является диметиламиноэтиловый эфир дифенилиропилуксусной кислоты, более известный под плаванием SKF-525A:[214]
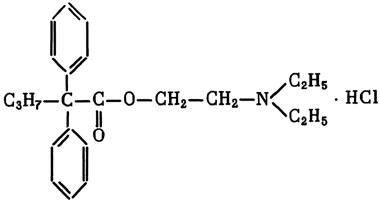
Этому веществу посвящены десятки исследований, которые с убедительностью показывают, что оно обладает свойствами универсального ингибитора ферментативных реакций превращений в организме многих чужеродных веществ, в том числе ядов. Так, было обнаружено, что, вводя животным препарат SKF-525A, можно защитить их от отравляющего действия одного из высокотоксичных ФОС — октаметила.[215] Оказалось, что антидотный эффект препарата SKF-525A связан с его способностью подавлять окислительные ферменты, которые в печени активируют превращение октаметила в значительно более токсичное вещество — оксиметил:
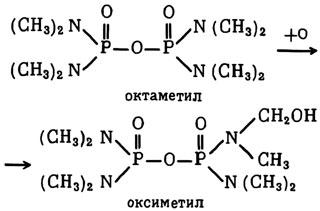
И наоборот, в тех случаях, когда окислительные или иные реакции превращения чужеродных веществ приводят к их детоксикации, препарат SKF-525A, угнетая эта реакции, усиливает биологическую активность чужеродных веществ. Это можно видеть на примере наркотиков (морфина, кодеина и др.) и снотворных из группы барбитуратов, действие которых резко усиливается и удлиняется при предварительном введении животным (крысам, кошкам, — собакам) препарата SKF-525A. Дальнейшие исследования показали способность препарата SKF-525A как политронного блокатора процессов биотрансформации тормозить такие реакции, как дезаминирование, восстановление, синтез с глюкуроновой кислотой.
Пока нет еще точных данных, позволяющих представить интимный механизм действия активаторов и ингибиторов процессов превращения ядов в организме. Можно лишь с достаточной достоверностью считать, что основным местом, где развертывается действие этих веществ, является микросомальная фракция печеночных клеток, в которой вырабатывается большинство ферментов-биотрансформаторов. При этом активаторы увеличивают число молекул микросомальных ферментов, ускоряя их синтез или снижая скорость распада. Ингибиторы оказывают противоположный эффект.
Согласно одним данным, активаторы вмешиваются в функции генетических систем синтеза ферментных (белковых) структур посредством ускорения образования молекул информационной РНК.
С другой стороны, полагают, что на молекулярном уровне эффект ингибиторов может заключаться в конкурентном их взаимодействии с ферментами — катализаторами превращений ядов в организме. Например, установлено,[216] что препарат SKF-525A реагирует с активными центрами фермента N-деметилазы, инактивирующей в организме морфин. Тем самым ингибитор пролонгирует действие наркотика.
Таким образом, химические соединения — стимуляторы и блокаторы процессов биотрансформации ядовитых веществ с достаточным основанием могут быть причислены к противоядиям и как справедливо отметил профессор В. И. Розенгарт,[217] дальнейшее изучение этих соединений при все возрастающем интересе к ним как биохимиков, так и токсикологов будет способствовать разработке новых действенных специфических средств борьбы с отравлениями.
В последние годы появилось немало доказательств усиления реакций превращения многих чужеродных соединений посредством предварительного введения этих веществ в организм в малых дозах. Давно было отмечено, что ряд ядовитых веществ при повторном поступления в организм постепенно теряет первоначальную токсичность и что при этом развивается привыкание к ним на более или менее длительный период. В связи с этим можно вспомнить антидот царя Митридата. Как уже отмечалось, постепенно увеличивая принимаемую внутрь дозу яда, Митридат достиг того, что мог совершенно безопасно принимать такое его количество, которое для всякого другого оказалось бы смертельным. Такого рода устойчивость к высокотоксичным веществам, формирующаяся в организме путем постепенного длительного их приема, была впоследствии названа митридатизмом. Это явление наиболее часто отмечалось при употреблении снотворных и наркотических веществ. Уже в нашу эпоху фантастическую устойчивость организма к громадным дозам наркотика (опиума) продемонстрировал английский писатель Томас Квинсей (1785–1859 гг.), который в течение почти 20 лет практиковал свою собственную форму митридатизма, основанную на своеобразной иммунизации организма ядом. «В кульминационной фазе моей карьеры опиомана, — писал Квинсей, — … моя ежедневная норма составляла восемь тысяч капель опия, что означает обычную больничную дозу на 320 больных».[218] В настоящее время такая резистентность организма связывается с активированием ферментативных процессов обезвреживания ядов, что в свою очередь сопровождается образованием и выделением все возрастающего количества биологически инертных метаболитов. По-видимому, в ответ на повторное введение чужеродного вещества организм интенсивно формирует для борьбы с ним все большее количество ферментов-инактиваторов. Это явление, получившее название самостимуляции ферментов, или ослабления эффекта дозы, есть, следовательно, не что иное, как ускоренный синтез белков-катализаторов, способствующий адаптации организма к токсическому воздействию. Кроме того, надо иметь в виду, что помимо самостимуляции ферментов в реакциях организма на повторяющееся воздействие того или иного химического агента проявляется снижение чувствительности к нему соответствующих рецепторных структур.
Нечто подобное можно видеть при повторяющемся приеме одной и той же дозы некоторых лекарств. Это, например, наблюдается при применении больными бутадиена (фенилбутазона) — болеутоляющего и жаропонижающего препарата, когда обычная его суточная доза дает прогрессивно уменьшающийся эффект. Сходное явление было продемонстрировано в опытах на мышах и крысах, у которых при регулярном введении фиксированных доз барбитуратов сон становился все менее продолжительным. Индукция синтеза ферментов, вызывающих биотрансформацию этих и ряда других лекарственных веществ при их повторном введении, доказана экспериментально. При этом возвращение содержания микросомальных ферментов к исходному уровню наблюдалось не ранее чем через 10 недель после лекарственного воздействия. Здесь уместно отметить, что названные лечебные препараты могут стимулировать функцию ферментов, инактивирующих другие лекарственные вещества, в частности дикума-риновые антикоагулянты. Вот почему последние могут не оказать лечебного действия, если больные одновременно получают барбитураты или бутадион.[219] С другой стороны, в последнее время была показана возможность развития так называемой энзиматической адаптации, когда продолжительное влияние на организм некоторых ядов ведет к усилению их токсичности из-за активирования ферментов, разрушающих глюкуроновую кислоту и другие вещества, необходимые для образования безвредных конъюгатов. Подобное явление может наблюдаться также тогда, когда многократное токсическое воздействие стабилизирует ферменты, трансформирующие яды в опасные для организма продукты. Например, при повторяющемся введении животным малых доз метилового спирта резко усиливается его действие вследствие, по-видимому, активирования алкогольдегидрогеназы и ускорения превращения яда в высокотоксичные метаболиты. Таким образом, сами ядовитые вещества в определенных условиях могут оказаться специфическими средствами направленного воздействия на токсический процесс.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК