Глава 35. Химия и электролиз
Под элементами я понимаю… некоторые первичные простые тела, которые нельзя разложить на части и невозможно получить из каких-либо других тел, а также друг из друга. Все сложные вещества составлены из этих элементов и в конечном счете распадаются на них.
Роберт Бойль, 1661 г.
Мы не можем быть уверены, что вещество, которое мы сейчас принимаем за элемент, является таковым на самом деле. Мы лишь в состоянии сказать, что такая субстанция является пределом возможностей современного химического анализа, и ее нельзя расщепить на более простые части, по крайней мере в настоящее время.
Антуан Лоран Лавуазье, 1789 г.
Эта глава предназначена для тех читателей, которые не знают химии. В ней излагаются основы химической науки, необходимые для изучения атомной физики, изложенной в пятой части настоящей книги.
Если у вас не было курса химии, то загляните в эту главу, чтобы получить общее представление о химических превращениях, атомном весе, атомном номере, ионах и т. п.
Если же вы уже знакомы с химией, то ваши знания, безусловно, шире и глубже того, о чем здесь говорится. Поэтому проявите снисходительность, читая эту главу.
ЧТО ТАКОЕ ХИМИЯ
Рассказать о химии в одной главе — все равно что одной короткой фразой описать содержимое бакалейной лавки: «На полках там стоит много банок со съестным и т. д.». Поэтому мы поставим себе задачу изложить только наиболее важные факты и основные представления химии и не будем раскрывать все богатейшее содержание этой науки или весь арсенал ее искусных средств. Мы обойдем молчанием и драматическое описание истории ее возникновения из средневековой алхимии и впечатляющее применение ее достижений в наш век логики и эксперимента. Мы перечислим только ее основные результаты — точнее, те взгляды, с которыми химики пришли к началу нашего столетия[79].
Химическое производство и методы. Синтез
Сначала ремесленники-красильщики, а впоследствии и ученые-химики научились приготовлять множество самых разнообразных веществ. В их работе широко применялись такие «физические методы», как растворение в воде, фильтрование и выпаривание растворов, дистилляция, электролиз и т. п. Но были и чисто «химические методы», как, например, нагревание двух смешанных друг с другом веществ с целью получить новое, отличное от них вещество, проведение химических реакций с помощью пламени и взрывов, получение газов при смешивании некоторых растворов и т. п. Провести границу между этими двумя понятиями очень трудно: нагревание минерала похоже на физический процесс, но оно же может привести и к химическим изменениям.
Начала химических знаний зародились на заре цивилизации. Первыми руководствами по химии были тщательно оберегаемые рецепты красильщиков и алхимиков. Современная химия напоминает сложнейшую кулинарную книгу — с анализом и рецептами, обоснованиями и правилами. «Чтобы приготовить омлет, — говорится в обычной поваренной книге, — нужно взять четыре яйца, немножко масла, щепотку соли». Если отвлечься от неопределенности в количестве этих продуктов, то такой рецепт похож на научную инструкцию по приготовлению омлета, его синтезу.
В химии многие вещества создаются в результате синтеза. Например, воду можно получить при взрыве смеси кислорода и водорода, двуокись углерода — при сжигании угля, а серную кислоту — в результате сгорания серы на воздухе с небольшими добавками избыточного кислорода (в присутствии платины, способствующей их соединению), а затем смешивания образующейся газообразной трехокиси серы с водяным паром.
Химический анализ
Поговорим теперь о процессе, обратном приготовлению омлета, о выделении его составных частей или анализе, который осуществить много труднее, даже если мы не начали поджаривать наш омлет. Но химик захотел бы пойти еще дальше. Разделив вещества, необходимые для приготовления омлета, он стал бы разлагать их на еще более простые вещества, такие, как вода, соль и др. Последние тоже представляют собой химические соединения, которые можно разложить на составные части. Например, яичный желток является не простым веществом, а смесью, из которой можно выделить несколько компонентов, а соль уже представляет собой отдельное химическое соединение. Она сохраняет свои физические свойства, какую бы малую ее часть мы ни взяли. Мельчайшая крупинка соли будет тем же кристаллом кубической формы, с той же плотностью и температурой плавления и будет так же преломлять световые лучи. При растворении в воде она даст одинаковое, пропорциональное разведению понижение точки замерзания. (Этот тонкий эффект используется в физической химии для оценки молекулярного веса.) И все же эти критерии довольно грубы, они не могут доказать, что поваренная соль не является однородной смесью, такой, как, например, стекло. Только химический анализ может сказать нам о том, что мы имеем дело с единым соединением, все молекулы которого одинаковы. Приведем два из бесчисленного множества примеров. Поваренную соль бросают в воду и получают соленый на вкус раствор (химический признак), который становится мутным при смешивании с солями серебра (анализ на хлориды). Каждый такой опыт с поваренной солью дает одинаковые результаты безотносительно к количеству взятой соли и независимо от того, получили ли мы ее путем рекристаллизации или очистили другим способом и сделали ли это однажды или повторяли такой процесс много раз. Переходя ко все меньшим количествам соли и даже к сильно разбавленным растворам ее, мы встретимся с некоторыми практическими трудностями, но не заметим никакого изменения самой природы превращений. Отмечая постоянство химических свойств поваренной соли, мы можем перенести, экстраполировать их на ее отдельные молекулы. Только тогда, когда будут обнаружены свойства, отличные от свойств поваренной соли, мы сможем считать, что расщепили ее молекулы на атомы составляющих их элементов.
Теперь, когда мы узнали, что смеси можно разделить на простые однородные вещества, подобные поваренной соли, пора пойти дальше в построении химической науки по пути разложения химических соединений, если они действительно являются соединениями, на составляющие их первичные элементы. Это и есть те самые элементы, о которых 300 лет назад писал Роберт Бойль (см. эпиграф в начале главы).
Возвращаясь к нашему примеру чистого вещества, кусочку поваренной соли, зададим себе вопрос, подошли ли мы к пределу делимости или можно разложить соль на еще более простые вещества — элементы? Итак, сложное ли вещество — поваренная соль?
Электролиз — способ выделения элементов
Да, соль можно расщепить на элементы, применяя более интенсивные методы анализа, например электролиз, т. е. пропуская электрический ток через раствор или другую жидкость с целью получения искомых продуктов, которые выделяются на погруженных туда электродах. Расплавим соль и пропустим через нее электрический ток. Мы заметим, что при этом появляются два новых вещества, свойства которых резко отличаются от соли. На одном электроде образуются пузырьки хлора — зеленоватого, ядовитого, удушливого газа, на другом выделяется серебристо-серый металл — натрий. При этом поваренная соль разложится полностью. Дальнейшее разложение, скажем, частично на соль, а частично на песок — невозможно. Натрий и хлор — это элементы, из которых образована поваренная соль. Таким образом, элементы — это простейшие вещества, на которые расщепляются все соединения, но которые сами не поддаются дальнейшему расщеплению. Как только мы научились выделять элементы и узнали их свойства, мы получили основной строительный материал для синтеза всевозможных других веществ. Обыкновенная поваренная соль разлагается на элементы натрий и хлор всегда в одной и той же пропорции: каждые 117 кг соли дают 46 кг натрия и 71 кг газообразного хлора. Тот факт, что из любых количеств соли натрий и хлор всегда выделяются в той же самой пропорции 46:71, однозначно характеризует это химическое соединение и дает убедительное подтверждение тому, что мы имеем дело всегда с одним и тем же простым веществом. Этот факт не только помогает нам лучше представить себе атомы, но дает даже большее: мы можем считать, что элементы натрий и хлор состоят из мириадов одинаковых атомов, только атомы хлора приблизительно в 1,5 раза тяжелее атомов натрия. Тогда поваренная соль состоит из отдельных групп атомов (молекул), по одному атому натрия и хлора в каждой, соединенных вместе какой-то таинственной силой. Если же массы этих двух видов атомов находятся в отношении 46:71, а мы в настоящее время знаем, что это действительно так, то легко понять, почему они входят в поваренную соль всегда в неизменной пропорции. Как само представление об атомах, так и соотношение масс 46:71 остаются непроверенными предположениями, пока они объясняют только свойства обыкновенной соли. Но когда мы узнаем, что постоянство содержания элементов выполняется опять и опять при переходе от одного вещества к другому, то атомная гипотеза получает серьезную поддержку и признание. Начав искать аналогичные соотношения между массами атомов в других химических превращениях, мы тут же их находим. Таким образом, мы приходим к пониманию сущности химии и узнаем, что она может предсказывать и объяснять результаты опытов, т. е. является наукой в подлинном смысле этого слова.
Смеси… Соединения… Элементы…
Понимание различия между смесями, соединениями и элементами является необходимой основой изучения химии, поэтому мы начнем этот раздел с нескольких примеров.
Насыпьте кучку из песка, соли, железной пыли и древесных опилок и хорошо их перемешайте. В какой бы пропорции они ни были взяты, вам всегда удастся снова разделить их, имея ковш воды и магнит. Эти вещества образовали смесь. Если песок состоит из камешков, то это будет грубая смесь, из которой их можно непосредственно достать руками. Если же песок и другие частицы очень малы, то такую смесь мы называем тонкой, но и ее удается рассортировать вручную под микроскопом или с помощью других более искусных методов.
Можно приготовить еще более тонкие смеси различных веществ, например, растворяя поваренную соль в воде, сливая вместе воду и спирт или сплавляя цинк и медь для получения латуни. Это будут молекулярные смеси, которые уже нельзя рассортировать руками. Воздух тоже представляет собой смесь газов — азота, кислорода, углекислого газа, а также небольшого количества гелия и других благородных газов. Пропорции, в которых составлены эти смеси, могут быть самыми разнообразными, поскольку названные вещества смешиваются в широких пределах. Тем не менее разделить эти смеси всегда удается. Вы можете выпарить воду из раствора, благодаря чему соль выпадает в виде кристаллов, провести дистилляцию спирта, выделить медь путем электролиза, охладить газы до жидкого состояния и дать им поочередно выкипеть. Теперь рассмотрим составные части смесей: поваренную соль, спирт, воду, медь — и зададим вопрос, является ли каждая из них также смесью? Все они обнаруживают постоянные физические свойства — плотность, температуру плавления, кристаллическую форму и т. п. Ни одно из этих веществ не проявляет никаких признаков смесей, которые могли бы быть составлены в разнообразных пропорциях и рассортированы в виде различных молекул каким-либо фантастическим демоном. Напротив, каждое из них обладает свойствами, присущими соединению (или элементу): части, из которых оно состоит, входят в него в постоянных пропорциях. Соединения — это единые по своей природе вещества, однородные по составу от больших количеств до последней молекулы. Их определение фактически совпадает с определением молекулы — мельчайшей отдельной частицы вещества, которая обладает всеми его характерными свойствами. Молекула представляет собой всегда одинаковую для одного и того же химического соединения группу атомов, удерживаемых вместе электрическими силами.
Попытаемся разложить поваренную соль на еще более простые вещества. Такие не очень действенные методы, как нагревание или охлаждение, не дают никаких окончательных изменений. Только электролиз расплавленной соли превращает ее в газообразный хлор и натрий. Электролиз воды также вызывает ее превращение в два других газа — кислород, в котором ярким пламенем сгорают горючие вещества, и водород, легчайший из газов, образующий с кислородом взрывчатую смесь. Можно ли расщепить эти новые вещества на еще более простые? Все попытки осуществить это путем нагрева до очень высоких температур, повторного электролиза, даже путем воздействия другими очень агрессивными химическими веществами терпят неудачу[80]. Поэтому мы называем эти химические вещества элементами. Железо и медь — это тоже элементы, как и углерод, ртуть, алюминий, йод, но не латунь или воздух, которые представляют собой смеси, и не вода или поваренная соль, относящиеся к соединениям. При синтезе, разложении и превращении веществ мы никогда не меняем самих элементов. Они остаются неизменными первичными кирпичиками во всех химических процессах[81].
«Образование одного вещества из других посредством химических превращений возможно только в том случае, если в этих других веществах присутствуют все необходимые элементы. Хотя такое утверждение нигде не выражалось в виде закона, оно тем не менее является фундаментальной аксиомой, отличающей химию от алхимии»[82].
Вернемся к анализу обычной поваренной соли и зададим вопрос: откуда известно, что натрий и хлор представляют собой элементы, т. е. первичные составные части, а не какие-то промежуточные вещества? Хотя теперь мы знаем это безошибочно, нужно напомнить, что признание многих веществ элементами пришло не сразу и первое время следовало лишь из безуспешных попыток расщепить их на еще более простые части. Некоторые вещества, такие, как золото, серебро, свинец, считались элементами уже очень давно, еще с тех пор, когда они были получены в тиглях средневековых алхимиков. Значительно позже, когда удалось выделить из воздуха несколько различных газов, было установлено, что азот и кислород также не поддаются дальнейшему разложению: при действии на них другими химическими веществами всегда получалось увеличение веса конечного продукта, а не расщепление его на более простые части с меньшими весами. Газ, который мы теперь называем углекислым, оказывается возможным разложить на газообразный кислород и черную сажу (или даже чистой воды алмаз), и он легко синтезируется из них (при сгорании углерода). Долгое время вода тоже считалась элементом, пока Кавендиш не расщепил ее на газообразные кислород и водород. Вода сначала была названа НО, так как считалось, что в каждой молекуле воды соединились по одному атому кислорода и водорода. Прошло длительное» время, пока химические опыты и другие аргументы не заставили ученых поверить, что настоящая формула воды Н2О.
В течение длительного периода развития химии неудачи попыток расщепить вещество на составные части были для химиков единственной надежной гарантией того, что они имеют дело с элементом. Затем сто лет назад Менделеевым, а также другими учеными была предложена стройная упорядоченная система элементов. Об этой системе, называемой в настоящее время периодической, мы вкратце расскажем в этой главе несколько позже. Она представляет собой нечто вроде генеалогического древа элементов, расположенных в соответствии с их атомными весами и химическими свойствами. Периодическая система служит великолепным поясняющим руководством, поэтому в каждой книге по химии она упоминается, пожалуй, гораздо чаще, чем родословная героев в иных детективных рассказах. Все вещества, про которые мы сейчас знаем, что они являются элементами, располагаются в ней в удивительно простом порядке, указывая на правильность первоначальных догадок об их природе[83]. В настоящее время окончательное решение, является ли данное вещество элементом, принимается на основании измерений частот его спектральных линий, лежащих как в рентгеновской, так и в видимой световой областях.
Химические превращения, или реакции
В качестве примера химических реакций, которые современный химик объясняет как обмен электронами между атомами, мы рассмотрим превращения, происходящие с углекислым газом. Углекислый газ, СО2,— это тяжелый бесцветный газ, который получается при сжигании угля в атмосфере кислорода или образуется (вместе с водой) при окислении или расщеплении питательных веществ (таких, как, например, сахар) в живом организме. В процессе горения атомы углерода присоединяют по две молекулы кислорода, образуя тяжелые молекулы СО2. В обычных условиях этот газ не отдает свой кислород для поддержания горения других веществ — атомы кислорода связаны в нем очень прочно, поэтому им можно погасить не только легкое пламя, но даже и большой пожар. Этот газ слегка ядовит, он вреден для живого организма тем, что препятствует нормальному газообмену в легких. Углекислый газ растворяется в воде, придавая ей слабый кислый привкус (и образуя хорошо знакомый напиток — газированную воду). При этом получается непрочное химическое соединение, известное под названием угольной кислоты (СО2 + Н2О = Н2СО3), или гидрокарбоната, так как радикал СО3 (который в свободном состоянии не существует) называется карбонатом. Если добавить в раствор поваренную соль (хлористый натрий), то там образуется весьма сложная смесь. Опыты по электролизу водных растворов показывают, что при растворении подобных веществ они расщепляются на электрически заряженные атомы или группы атомов (радикалы), называемые ионами. Можно представить, что в полученной нами смеси будет присутствовать некоторое количество положительных ионов натрия, отрицательных ионов хлора, положительных ионов водорода и отрицательных ионов СО3. Теперь уже нельзя сказать, что там есть хлористый натрий и угольная кислота или соляная кислота и карбонат натрия, или даже смесь всех четырех веществ, так как при растворении в воде любая пара разнородных молекул образует те же самые четыре иона. Вероятнее всего, каждая из комбинаций то объединяется, то расщепляется снова, так что все молекулы находятся в неустойчивом состоянии.
Наши рассуждения будут бездоказательны до тех пор, пока мы не удалим из раствора какое-либо вещество, чтобы расстроить установившееся там равновесие. Однако сейчас это не так-то легко сделать, поскольку все они растворены в воде. Предположим теперь, что мы смешали растворы другого карбоната и другого хлорида, например карбоната натрия (соды) и хлористого кальция (вещества белого цвета, которым посыпают зимой тротуары, чтобы с них стаял лёд). И в этом случае раствор будет содержать смесь ионов — ионы натрия, ионы кальция, ионы хлора и ионы карбоната. Спросим опять, что же мы имеем на этот раз: карбонат натрия и хлористый кальций или хлористый натрий и карбонат кальция, или же какое-то промежуточное вещество? В рассматриваемом примере одна из получающихся комбинаций не растворима в воде. Случайные столкновения между ионами приводят к образованию молекул карбоната кальция, которые уже не растворяются в воде, а собираются в мельчайшие белые крупинки мела и выпадают из раствора в виде твердого осадка. Такой необратимый процесс происходит до тех пор, пока осаждение углекислого кальция не прекратится из-за того, что его уже просто не останется в растворе. Отфильтрованный и просушенный осадок представляет собой чистый мел, и его можно использовать по назначению. Здесь мы имеем наглядный пример химического производства.
Однако было бы неразумно и неудобно получать мел таким способом (если только мы не нуждаемся в особо чистом продукте), поскольку его можно непосредственно добывать в горных карьерах. Откроем секрет, что те вещества, которые использовались в нашем химическом «производстве», вероятно, и были приготовлены из этого натурального мела.
Взяв в качестве исходного сырья мел, мы можем разложить его прокаливанием на углекислый газ и известь. Известь, или окись кальция, — это белый порошок, получающийся при «ржавлении» на воздухе металлического кальция. 100 кг мела дают 56 кг извести и 44 кг углекислого газа. Практически этот процесс используется, конечно, не для получения углекислого газа, а в первую очередь для производства извести, которая необходима для сельского хозяйства и химической промышленности. Известь немного растворяется в воде, образуя слабый горьковатый раствор, содержащий ионы кальция и, вместо ожидаемых ионов кислорода, ионы гидроксила ОН-, которые получаются в результате ее взаимодействия с водой при растворении.
Взяв продукты разложения мела, полученные путем прокаливания (при котором его молекулы как бы разбиваются сильными ударами микроскопических молоточков), мы можем снова соединить их вместе. Известь + углекислый газ опять образуют мел. Однако эту реакцию трудно провести с кусками твердой извести, так как доступ к ней углекислого газа затруднен. Гораздо лучше растворить известь в воде и пропускать углекислый газ через раствор. При этом будут хорошо видны белые облачка образующегося мела[84].
Химические формулы и уравнения
Факты, с которыми мы здесь сталкиваемся, становятся все более сложными и трудными для понимания и запоминания. Химики стараются упростить их, используя лаконичные уравнения, которые показывают, как атомы элементов соединяются или замещают друг друга. Эти уравнения выражают их уверенность в неуничтожимости материи и неизменности составляющих эту материю атомов, которая позволяет им записывать по одинаковому числу атомов одного и того же элемента в обеих частях уравнения. Атомы не исчезают, их «баланс» всегда сходится. Каждый атом мы изображаем одной буквой (или, где это необходимо во избежание неопределенности, двумя буквами). Атом углерода обозначается буквой С, кислорода — буквой О, кальция — буквами Са, хлора — буквами Сl. Для водорода, азота, серы приняты обозначения Н, N, S. Атом натрия записывается Na, что происходит от старого латинского названия поваренной соли natrium, а атом меди Си (от cuprum). Соединение одного атома кальция и одного атома кислорода — окись кальция (известь) обозначается СаО. Если же молекула какого-либо соединения содержит два одинаковых атома, то после их символа пишется индекс 2, например СО2 или H2SO4[85].
Химическое превращение, происходящее при сжигании угля, о котором мы уже говорили, изображается так;
С + О2 = СО2
[углерод + кислород дают углекислый газ].
[Один атом углерода соединяется с содержащей два атома молекулой кислорода, образуя одну молекулу углекислого газа.]
Сейчас вы уже накопили достаточно знаний, чтобы догадаться, что атомы кислорода, водорода, хлора и многих других газов объединяются в молекулы по два, т. е. образуют молекулы О2, N2 и т. д. Действительно, имеются весьма веские основания записывать их именно таким образом (разумность этого, в частности, заключается в следующем: одноатомный водород Н в отличие от двухатомного Н2 отвечает свободному, только что рожденному агрессивному атому водорода, с жадностью вступающему в химические реакции).
Другое, знакомое нам превращение:
CO2 + H2O = H2CO3.
[Одна молекула углекислого газа при растворении соединяется с одной молекулой воды, образуя молекулу угольной кислоты.]
Мы помним также, что Н2СО3 может расщепляться на ионы водорода Н+, Н+ и ион СО3, т. е. СО3-:
H2CO3 H+ + H+ + CO3-
При сливании растворов хлористого натрия и угольной кислоты смесь остается совершенно прозрачной, а при смешивании растворов углекислого натрия Na2CO3 и хлористого кальция СаСl2 мы видим облачко осаждающегося мела:
Na2CO3 + СаСl2 = СаСО3 + 2NaCl[86].
Зная, что растворенные вещества могут расщепляться на ионы, осторожный химик написал бы такое уравнение для электрически заряженных ионов и заменил бы знак равенства «=» стрелками  , которые означают, что процесс может протекать в обоих направлениях. Но если бы он заметил, что одна из четырех комбинаций СаСО3 нерастворима, то поставил бы только одну стрелку;
, которые означают, что процесс может протекать в обоих направлениях. Но если бы он заметил, что одна из четырех комбинаций СаСО3 нерастворима, то поставил бы только одну стрелку;
Na2CO3 + CaCl2 —> CaCO3 + 2NaCl.
Возьмем теперь наш только что полученный мел СаСО3 и прокалим его;
CaCO3 CaO + CO2
[мел превращается в известь и углекислый газ].
Здесь стрелки направлены в обе стороны, так как реакция может идти в любом направлении в зависимости от температуры. Растворяясь в воде, известь образует раствор гидроокиси кальция:
CaO + H2O —> Ca(OH)2
Гидроксильная группа ОН входит в состав самых едких щелочей, хотя сама известковая вода обладает весьма слабыми щелочными свойствами. Опустим в воду небольшой кусочек металлического натрия, и он вырвет атом водорода из молекул этой нейтральной жидкости, образуя сильную щелочь:
Na + H2O —> NaOH + H
[натрий и вода дают гидроокись натрия и водород].
Выделяющиеся пузырьки газообразного водорода говорят нам о том, что нужно удвоить это уравнение и записать его в виде
2Na + 2Н2О —> 2NaOH + Н2.
Гидроокись натрия (каустическая сода, или едкий натр) — это мыльный на ощупь, едкий щелочной раствор, нейтрализующий кислоты
2NaOH + H2SO4 —> Na2SO4 + Н2О.
[Гидроокись натрия (каустическая сода) + серная кислота (сернокислый водород) дают сернокислый натрий и воду.]
Кислоты
Все кислоты содержат водород и неметаллические элементы (хлор в соляной кислоте, сера и кислород в серной). Для кислот характерно, что входящие в них атомы водорода в водном растворе становятся ионами Н+, придавая ему кислый вкус. (В растворах щелочей в противоположность этому образуются ионы ОН-.)
Распознавать кислоты по их кислому вкусу все же опасно, лучше познакомиться с их другими свойствами. Кислоты способны нейтрализовать щелочи, образуя воду и выделяя тепло. Они реагируют со многими металлами, которые замещают в них водород. Большинство кислот вытесняет углекислый газ из растворов карбонатов.
Мы можем непосредственно получить соляную кислоту, смешивая равные объемы водорода и тяжелого зеленоватого газа хлора или беря их в весовой пропорции 2:71 и вызывая взрывную реакцию с помощью вспышки ультрафиолетового света:
Н2 + Сl2 —> 2HCl
[водород + хлор образуют при взрыве пары хлористого водорода, или гидрохлорида].
Хлористый водород — легко растворяющийся в воде газ, образующий концентрированные растворы с очень кислым вкусом. Обычная соляная кислота и есть раствор хлористого водорода. Она широко применяется в химической промышленности и участвует в пищеварении человека.
Простейший способ получения углекислого газа в лабораторных условиях — подействовать соляной кислотой на мел:
CaCO3 + 2HCl —> СаСl2 + Н2О + СО2.
Если продувать СО2 через раствор едкого натра, то последний реагирует с ним с образованием карбоната. (Если хотите, можно сказать, что СО2 дает угольную кислоту Н2СО3, которая затем нейтрализует щелочь NaOH.)
2NaOH + CO2 —> Na2CO3 + H2O.
Серную кислоту можно получить из минеральной необработанной серы:
S + O2 —> SO2
[сера при сгорании образует двуокись серы]
и затем
2SO2 + O2 —> 2SO3
[двуокись серы присоединяет добавочный атом кислорода].
Чтобы осуществить последнюю реакцию, необходимо привести газы в контакт с платиной, которая действует подобно посреднику, ускоряя реакцию, но выходя из нее неизменной. Такие вещества мы называем катализаторами. Эта реакция медленно протекает слева направо, если платина не нагрета, а при очень высоких температурах идет в обратном направлении. Поэтому ее следует записать так:
2SO2 + O2 2SO3
и если нам необходимо наладить производство серной кислоты, то нужно выбрать такую температуру, чтобы реакция быстро протекала слева направо. Затем, растворяя SO3 в воде, получаем
SO3 + H2O —> H2SO4
[трехокись серы, соединяясь с водой, образует серную кислоту].
Щелочи
Щелочи — это вещества, которые при растворении в воде образуют ионы гидроксила (ОН)-. Обычно они представляют собой окиси или гидроокиси металлов. Большинство металлов на воздухе покрывается пленкой, которую мы и называем окисью. Железо ржавеет, медь становится тусклой, на кальции образуется белая корка извести, а натрий присоединяет кислород и влагу столь энергично, что его приходится хранить погруженным в масло. Некоторые из этих окислов не реагируют с водой, другие же растворяются или вступают с ней в реакцию, образуя гидроокиси.
Ионы гидроксила (ОН)- сообщают этим растворам характерный горький вкус и способность нейтрализовать кислоты, а также оказывают разъедающее действие на кожу. Примерами щелочей являются гидроокись натрия NaOH, гидроокись кальция Са(ОН)2, гидроокись аммония NH4OH, где группа аммония NH4 ведет себя подобно металлу.
При смешивании растворов кислоты и щелочи ионы Н+ и (ОН)- соединяются, образуя воду и выделяя значительное количество тепла. Если эти растворы взять в нужной пропорции, то продукты реакции будут нейтральными веществами, не обладающими свойствами ни кислоты, ни щелочи[87]. (Конечно, если одно из веществ было в избытке, то раствор будет показывать характерные для этого вещества свойства.)
НСl + NaOH —> NaCl + H2O + (тепло)
[хлористый водород (соляная кислота) + гидроокись натрия (каустическая сода) образуют хлористый натрий (поваренную соль) + воду], или
H2SO4 + 2NaOH —> Na2SO4 + 2H2O + (тепло)
[серная кислота (гидросульфат) + гидроокись натрия дают сульфат натрия + воду].
Оба эти примера иллюстрируют общее правило:
щелочь + кислота дают соль + воду + (тепло).
Здесь под словом «соль» понимаются многочисленные нейтральные соединения, одним из которых является обычная столовая соль. (Другие примеры солей: техническая сода, сульфат меди, хлористый кальций.) Соли — нейтральные соединения, однако по своей структуре они похожи на кислоты, в которых водород замещен одним или несколькими атомами металла.
Если подействовать гидроокисью натрия на «жирные кислоты», с которыми мы встречались в опытах по изучению поверхностного натяжения, то образующаяся в результате этой реакции соль оказывается обыкновенным мылом. Однако промышленный способ изготовления мыла является несколько более сложным.
ХИМИЯ И АТОМЫ
Доказательства существования атомов
В приведенных нами примерах химических превращений мы говорили об атомах, не приводя никаких доказательств в пользу их существования. В каждом уравнении буквы, отвечающие определенному элементу, например Н или Сl, означали «один атом» (водорода или хлора). Конечно, эти обозначения можно было бы считать просто удобным способом описания, понимая под ними «некоторое количество» водорода или «немного» хлора. Однако, когда мы пишем химическое уравнение, в обеих частях которого каждый символ появляется в равных количествах, мы подразумеваем тем самым, что атомы существуют, а число их сохраняется. Мы считаем, что каждый элемент имеет свои атомы, которые участвуют в обмене между молекулами, но не могут создаваться или исчезать. Эта уверенность основана на тщательных измерениях веса веществ, принимающих участие в химических реакциях. В настоящее время самым простым способом разложения веществ на элементы является электролиз. Пропустим через воду электрический ток, и на электродах появятся пузырьки водорода и кислорода в весовом отношении 1:8, а уровень воды начнет понижаться, причем понижаться очень медленно, поскольку вода гораздо плотнее, чем эти газы. (На получение каждого кубического метра смеси газов расходуется 1/2 кг воды, и эта смесь весит в точности 1/2 кг.
Вода, кислород и водород всегда сохраняют весовое соотношение 9:1:8.) Но воду можно разложить на водород и кислород и другими способами, например пропуская пар над докрасна раскаленным железом, которое забирает из воды весь кислород, освобождая водород. И опять на каждые 9 кг воды получается 1 кг водорода. С другой стороны, газообразный фтор отнимает у воды содержащийся в ней водород, в результате чего образуется кислород. При этом во всех случаях выдерживаются следующие весовые пропорции:
9 частей воды дают 1 часть водорода + 8 частей кислорода.
Те же самые весовые пропорции соблюдаются и при синтезе воды. Если мы взорвем смесь 1 кг водорода и 8 кг кислорода, то получим в точности 9 кг воды. (При смешивании в другой пропорции избыток газа не участвует в реакции, например 3 кг водорода + 8 кг кислорода —> 9 кг воды + 2 кг водорода.)
Как мы уже говорили раньше, при электролизе расплавленного хлористого натрия получаются газообразный хлор и сода в весовой пропорции 71:46. Сжигание углерода[88] в атмосфере кислорода дает СО2, в котором эти элементы находятся в пропорции 3:8. Если же доступ воздуха к горящему углероду ограничен, то образуется другое соединение — легкий ядовитый бесцветный газ, смесь которого с воздухом взрывоопасна. Этот газ называется окисью углерода (или угарным газом) и содержит углерод и кислород уже в пропорции 3:4. Неизменные пропорции содержания элементов в соединениях легко объяснить на основе представления о существовании однородных атомов каждого составляющего элемента. Это представление становится еще более убедительным, когда мы рассмотрим количественные соотношения между элементами в нескольких различных соединениях. Взгляните на следующую таблицу:

Изучение соотношений между элементами среди большого количества других химических соединений дает аналогичные результаты, которые убедительно подкрепляют атомную гипотезу. Если считать, что весь водород состоит из одинаковых легких атомов, то атомы кислорода будут тяжелее их в 8 или, возможно, в 16 раз, атомы хлора — в 35,5 раза, натрия — в 23 раза и т. д. Мы можем представить молекулу любого химического соединения состоящей из таких атомов. Ясно, что в молекулах различных соединений может присутствовать по нескольку атомов одного элемента. (Например, если гидроокись натрия — это NaOH, то вода будет Н2О, а если вода была бы НО, а не Н2О, то гидроокись натрия нужно было бы записать NaO2H.)
Использование количественной, основанной на опыте атомной теории необычайно облегчило понимание химических процессов и явилось огромным достижением науки. Эта теория в удивительно четкой форме была сформулирована Джоном Дальтоном приблизительно в 1808 г. Новые тщательные измерения и открытия ряда неизвестных элементов, сделанные Берцелиусом, Дэви и многими другими учеными, еще более способствовали ее быстрому прогрессу. Во всех химических процессах атомы вели себя так, что их относительная масса оставалась неизменной. Постоянное подтверждение этого правила в любых измерениях заставляет нас признать, что атомы реально существуют, и, придя к представлению о неизменных массах атомов, мы создали такую стройную концепцию, что нам трудно было бы отказаться от нее, даже если бы вдруг оказалось, что атомы — это только иллюзия!
Если все же наши представления правильны, если простейшие однородные атомы, которые могут объединяться друг с другом в молекулы, существуют, то можно сделать еще один важный вывод: когда одни и те же элементы образуют несколько различных соединений, то количества элементов в этих соединениях должны быть связаны между собой весьма простыми соотношениями. Этот так называемый Закон Кратных Отношений является одним из немногих законов, которые были сначала обнаружены теоретически и лишь затем подтверждены на опыте. Рассмотрим следующую таблицу:

(В этой таблице использованы числовые значения, которые демонстрируют простоту соотношений особенно наглядно. В действительности измерения не дают непосредственно столь простых соотношений.)
Если формулы воды Н2О, хлористой меди (закисной) CuCl, двуокиси углерода СО2 так просты, то изображаются ли другие вещества столь же простыми формулами?
Даже приведенные примеры не могут окончательно доказать, что атомы действительно существуют. По крайней мере один из выдающихся химиков прошлого столетия утверждал свое право не верить в них, пока, практически только в начале нашего века, эксперименты с атомными частицами (броуновское движение, опыты Милликена по измерению заряда е электрона и отношения заряда к массе e/m электронов и ионов, а также опыты по рассеянию альфа-частиц) не заставили признать атомы безусловно необходимыми для описания материи.
Мы далеки от утверждения, что простым взвешиванием можно измерить относительные массы отдельных атомов. Но как же узнать, в 8 или 16 раз масса атома кислорода больше, чем водорода? Широко известное соединение углерода и водорода — газ метан — содержит их в весовом соотношении 3:1. Можно ли записать метан в виде СН, сказав, что углерод только в 3 раза тяжелее водорода? Химики считают, что на самом деле формула метана СН4, т. е. соотношение между углеродом и водородом следует записать (4x3):(4х1) = 12:4, иначе говоря, углерод в 12 раз тяжелее водорода. Как удалось сделать такое важное заключение? Эта задача была решена с помощью хитроумного химического приема. Метан был обработан хлором, который заместил в нем водород. Если бы метан содержал по одному атому С и Н, то он превратился бы в ССl. Если же метан — это СН4, то в нем можно заменить на хлор 1, 2, 3 или даже 4 водородных атома. И в самом деле, действием хлора на метан были получены четыре различных химических соединения. Первое — тяжелый газ СН3Сl, второе — еще более тяжелый газ СН2Сl2, затем жидкость СНСl3 (хлороформ) и, наконец, ядовитая жидкость — четыреххлористый углерод ССl4.
Вот как распределяются весовые пропорции между элементами в этих веществах:
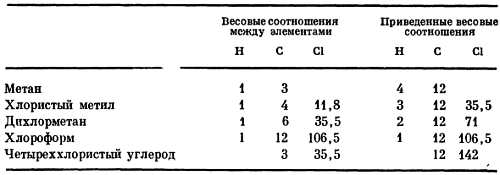
Как только вы разберетесь в этих соотношениях и приведете их к виду, который изображен в правой части таблицы, вам станет ясно, что масса атома углерода должна быть в 12 раз больше массы атома водорода. (Если, конечно, в действительности формула метана СН8, то атом углерода будет тяжелее не в 12, а в 24 раза. Однако в этом случае можно было бы ожидать появления еще и других хлорзамещенных метана, таких, скажем, как СН7Сl, которые в действительности не обнаруживаются. Имеются и другие убедительные доказательства, подтверждающие правильность выбора значения 12.)
Вернемся теперь опять к воде. Если ее формула НО, то отношение масс атомов водорода и кислорода 1:8. Почему же мы должны считать, что вода — это Н2О, т. е. что атом кислорода в 16 раз тяжелее атома водорода. Когда впервые было обнаружено, что вода содержит кислород и водород, ей как раз и приписали состав НО. Эта ошибка была исправлена только с появлением закона Авогадро, что в значительной степени помогло атомной химии прийти к ее современному состоянию.
Объемы газов и химические превращения
Современные методы взвешивания и точные расчеты показывают, что массы элементов относятся приблизительно как целые числа. Однако в прежние времена более легким и очевидным количественным методом было измерение объема газов. Если мы соединим водород и кислород при температуре, скажем, 100 °C и будем поддерживать образующуюся при этом воду в виде пара, то обнаружим, что 2 л водорода соединяются с 1 л кислорода, образуя 2 л пара, или 1 л хлора и 1 л водорода дают 2 л газообразной соляной кислоты, или при горении 2 л окиси углерода расходуется 1 л кислорода и получаются 2 л двуокиси углерода.
Можно привести десятки подобных примеров простых соотношений между объемами реагирующих газов. (Конечно, все измерения должны производиться при постоянной температуре и одном и том же давлении, скажем при давлении, равном атмосферному.)
Закон Авогадро
Вскоре после того, как Гей-Люссак указал на то, что объемы вступающих в реакцию газов подчиняются простым соотношениям, итальянский ученый Амадео Авогадро высказал блестящую догадку (~ 1813 г.), что (при любых выбранных температуре и давлении) равные объемы различных газов содержат одинаковое число молекул, т. е. независимо от сорта газа в одном и том же сосуде содержится равное число молекул. Авогадро так убедительно аргументировал свои мысли, что если бы вы прочитали его записи, то сочли бы заключения, сделанные им, неопровержимыми. Данные современной физики (см. гл. 30) полностью подтверждают правоту ученого, и мы называем этот закон законом Авогадро.
Применим закон Авогадро к химической реакции, в которой 1 л хлора (N молекул) соединяется с 1 л водорода. Этот пример иллюстрируется фиг. 167.
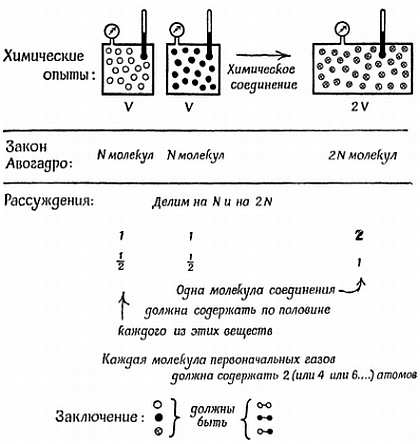
Фиг. 167. Доказательство двухатомного состава молекул водорода, хлора и хлористого водорода.
Опираясь на закон Авогадро, а также на экспериментальные факты, мы приходим к заключению, что одна молекула хлористого водорода содержит половину молекулы водорода и половину молекулы хлора; иными словами, обе эти молекулы должны обладать способностью делиться пополам. Это значит, что молекула водорода может быть Н2, Н4 или Н6, но не Н. Останавливаясь на самом простом предположении, будем считать, что она представляет собой Н2. Это предположение мы могли бы подкрепить соображениями такого рода, которые мы рассматривали, говоря о метане, хотя до сих пор ни один чисто химический эксперимент не исключил полностью возможность того, что правильным ответом было бы Н4 или Н6. По тем же самым причинам мы считаем, что молекула газообразного хлора должна быть Сl2. Что же мы можем сказать, основываясь на аналогичных аргументах, о реакции, в которой получается двуокись углерода? Что говорит нам реакция образования воды? Вы можете удостовериться сами, что воду необходимо записывать Н2О.
В любых химических реакциях, в которых исходными или конечными продуктами являются газы, мы снова и снова встречаемся с простыми соотношениями между их объемами — 1:1, 2:1, 3:2 и т. д. (при условии, что объемы измеряются при постоянных температуре и давлении). Связывая эти экспериментальные факты с законом Авогадро, мы все более убеждаемся в том, что сталкиваемся здесь с образованием или перестройкой молекул: одна молекула дает другую молекулу, из двух молекул получается одна или из трех две и т. д.
Атомные веса
Таким образом, в результате точных измерений масс веществ, участвующих в химических реакциях, а также объемов реагирующих и образующихся газов в науку вошла замечательная атомная гипотеза, т. е. представление о том, что каждый элемент имеет однородные атомы с характерной для них массой и что молекулы — это стандартные, родственные группы атомов. Простота количественных соотношений, которые дала атомная теория, оказала неоценимую помощь развитию химии. Но для широкого количественного использования теории химикам не хватало данных о массах атомов различных элементов, точнее, об их относительных массах, выраженных в некоторой удобной шкале. Эти массы удалось измерить путем тщательного взвешивания веществ, образующих химические соединения.
Относительные массы атомов в шкале, где за единицу принимается масса атома водорода, называются атомными весами. Результаты взвешиваний показали, что для О и Н, входящих в состав воды, соблюдается соотношение 8:1; измерение объемов этих газов показало, что состав молекулы воды — Н2О; таким образом, атомный вес кислорода должен быть равен 16. Соотношение 23:16:1 для Na, О и Н, входящих в состав гидроокиси натрия, показывает, что ее формула должна быть NaOH, а атомный вес натрия — 23.
К 1810 г. Дальтон исследовал около 20 элементов и приблизительно установил их атомные веса. С этого времени высокое экспериментальное искусство и тщательная логика исследования стали неотъемлемой чертой всех измерений атомных весов. Уже сто лет назад было изучено около трех четвертей из известных нам сейчас почти ста элементов, а их атомные веса измерены с достаточно хорошей точностью.
Если определить химическое соединение как вещество, содержащее составляющие его элементы в неизменных пропорциях, то мы не должны удивляться, узнав, что опыт действительно подтверждает постоянство содержания элементов в любом произвольно выбранном соединении! Итак, поистине удивительные и важные экспериментальные факты заключаются в следующем:
A) Существует бесчисленное количество веществ, каждое из которых обладает постоянным содержанием составляющих его элементов и определенными физическими[89] и химическими свойствами независимо от того, где оно было найдено или каким путем получено. (Если бы лишь немногие из веществ подчинялись этому правилу, то химия была бы совсем иной. Может быть, она оказалась бы и более простой, но, скорее всего, была бы перегружена изобилием разнообразных смесей.)
B) Элементы, входящие в различные соединения, находятся между собой в очень простых весовых соотношениях, указывая тем самым на то, что каждый атом одного и того же элемента имеет постоянную характерную массу независимо от того, в какой химической комбинации он находится[90]. Можно только удивляться, что все химические соединения построены по одинаковой схеме, причем каждый элемент обладает одним и тем же атомным весом во всех соединениях, куда он входит.
Откуда же химик берет уверенность, что при построении таблицы атомных весов он не опустил множитель 1/2, или 2, или 3? Если вода была бы НО, то кислород мог бы обладать атомным весом 8, а если гидроокись натрия была бы Na2OH, то атомный вес натрия стал бы 12,5 (заметим, что сернокислый натрий и в самом деле имеет 2 атома натрия в своей молекуле Na2SO4). Если же гидроокись натрия оказалось бы Na(OH)2, то атомный вес натрия был бы 46. В ряде случаев такие сомнения действительно возникают, но химики разработали хорошие способы разрешать их и находить правильный множитель. Пример с численными соотношениями между объемами газов позволяет принять нужное решение в случае кислорода и воды. Другое эмпирическое правило, установленное Дюлонгом и Пти, помогает определить атомный вес натрия. Это правило гласит, что для большинства элементов, находящихся в твердом состоянии[91],
АТОМНЫЙ ВЕС ∙ УДЕЛЬНАЯ ТЕПЛОЕМКОСТЬ ~= 6.
Удельная теплоемкость натрия близка к 0,3. Умножая это число на возможные значения атомного веса натрия, получаем
0,3 х 12,5 = 3,7; 0,3 х 23 = 6,9; 0,3 х 46 = 14,
т. е. правильным следует признать значение 23.
После создания периодической системы ошибочный выбор стало легко исключать на том основании, что вакантное место имеется только для правильного значения атомного веса. А в начале нынешнего века были созданы специальные приборы — масс-спектрографы (см. гл. 38), которые позволили непосредственно измерить одну за другой массы всех атомов. При подмешивании к исследуемому образцу атомов с известной массой, например водорода и кислорода, служащих в качестве калибровочных точек, масс-спектрограф позволяет получить однозначную шкалу для измерения атомных весов.
Зная атомный вес, мы можем рассчитать и молекулярный вес любого вещества, химическая формула которого нам известна. Молекулярный вес — это масса одной молекулы, выраженная в том же масштабе, что и атомные веса. (Не спутайте этот термин с молем, который относится к большому макроскопическому количеству вещества и которому можно дать следующее определение: «моль — это количество вещества, масса которого, выраженная в граммах, численно равна его молекулярному весу». В этой книге вы встретитесь и с киломолем, определение которого отличается только тем, что грамм заменяется килограммом.)
Если формула химического вещества нам не известна, но оно находится в газообразном состоянии, то его молекулярный вес (а из него и формулу) нетрудно найти экспериментально. Для этого нужно только измерить веса равных объемов неизвестного газа и, например, водорода, а затем с помощью закона Авогадро найти отношение масс молекул обоих газов. Поскольку мы знаем, что масса молекулы водорода Н2 в нашей шкале, по определению, равна 2, то можем сразу узнать искомую массу молекулы, т. е. молекулярный вес вещества. Последний в свою очередь может помочь нам найти атомный вес какого-либо из составляющих его элементов[92]. Для инертных газов, таких, как гелий, не образующих химических соединений, измерение плотности газа — это единственный способ узнать молекулярный вес, который совпадает у них с атомным весом.
Нельзя забывать, что, помимо большой практической ценности использования атомных весов в количественном анализе и химическом синтезе, они сыграли исключительно важную роль в развитии химии. При создании периодической системы элементы первоначально располагались в ней строго по порядку возрастания их атомных весов. Измерения атомных весов выявили одну замечательную особенность: в шкале, где атомный вес водорода равен 1, большинство их оказалось целочисленными. На это свойство указал английский физик Уильям Проут меньше чем через десятилетие после того, как Дальтон выдвинул атомную теорию химии. По мнению Проута, это свойство говорило о том, что атомы каждого химического элемента, по-видимому, построены из одинаковых составных частей, а именно атомов водорода. Такое объяснение выглядело крайне привлекательным не только из-за присущего ученым стремления к простоте, но также и потому, что отвечало традициям древнегреческой философии. Подобная идея невольно напрашивается сама, если взглянуть на следующую таблицу:
Даже во времена Проута не было недостатка в примерах, которые делали эту гипотезу весьма правдоподобной[93]. Однако вскоре нашлись и противоречащие ей исключения: многократные измерения атомных весов Сl и Си дали значения соответственно 35,45 и 63,5. От гипотезы Проута пришлось отказаться. Блестящая идея, но… пришлось подождать около ста лет, пока она не получила неожиданное объяснение (см. гл. 38 и 40). Это объяснение оказалось совсем необычным. Оно пришло вместе с совершенно новыми взглядами на природу атома, которые позволили предсказать возможность овладения «атомной энергией».
Валентность
Если нам известны атомные веса элементов, то дальнейший анализ покажет, в какой пропорции атомы входят в молекулы соединения. С помощью такого анализа нам удается узнать, что, например, молекула хлористого водорода содержит равное число атомов водорода и хлора, что в метане на каждые четыре водородных атома приходится один атом углерода, что газ ацетилен имеет равное число атомов водорода и углерода, а в хлористом алюминии атомов хлора в 3 раза больше, чем алюминия. Однако, установив пропорцию, мы еще не знаем числа атомов каждого элемента в молекуле. Скажем, хлористый водород мог бы быть НСl или Н2Сl2, или Н3Сl3, метан — СН4, С2Н8…, а ацетилен — СН, С2Н2… и т. д. Чтобы решить эту задачу, т. е. определить истинную формулу молекулы, необходимо определить ее молекулярный вес.
Если соединение представляет собой газ, то проще всего измерить его плотность и воспользоваться законом Авогадро. Например, пусть измерение плотности газа показало, что молекулярный вес газообразного хлористого водорода равен 36,4, таким образом, его формула должна быть НСl; молекулярный вес метана 16, т. е. его формула СН4; молекулярный вес ацетилена 26, т. е. его формула С2Н2.
При растворении твердых веществ в жидкостях в их поведении проявляется нечто общее с газами. К примеру, они создают некоторое добавочное давление на тонкие пленки из некоторых материалов, так называемое «осмотическое давление», которое нетрудно измерить. Кроме того, они немного меняют точку кипения и точку замерзания жидкости. Величина каждого из этих эффектов пропорциональна числу молекул (или ионов) растворенного вещества, и измерение любого из них позволяет оценить молекулярный вес.
Зная формулу молекулы, мы можем по-новому описать образование химического соединения, воспользовавшись очень удобным понятием валентности. Возьмем простые молекулы, состоящие из двух атомов, НСl, NaCl, H2, и вообразим, что каждый из атомов снабжен своеобразной связью, с помощью которой он может соединиться с соответствующей связью другого атома. Поэтому мы можем изобразить атомы в виде Н-, Сl-, Na-, а соединения — в виде Н-Сl и т. д. Однако нам известны и другие соединения: Н2О, СаСl2, СаО, которые показывают, что у атомов кислорода и кальция должно быть уже по две связи — О— (или О=)…
«Число таких связей» каждого атома мы называем валентностью. Водород, хлор, натрий, как и некоторые радикалы, например (ОН), обладают валентностью 1, они одновалентны. Кислород, кальций, а также радикал сульфат (SO4) имеют валентность 2. Валентность алюминия 3 (хлористый алюминий — это АlСl3). Формулы метана СН4 и углекислого газа СО2 показывают, что валентность углерода 4.
Это свойство углерода позволяет ему образовывать бесчисленное разнообразие соединений. Длинная цепочка радикалов — СН2—, изображенная в гл. 6, — лишь одна из тысяч типов таких цепочек, одно из многих миллионов его соединений. К ним мы еще вернемся, когда будем говорить об «органической» химии.
Некоторые из атомов, по-видимому, проявляют различную валентность. Медь имеет валентность 2 в сульфате меди CuSO4 и в одном из окисных соединений — СuО. Одновременно она способна образовывать закись Сu2О, ведя себя как одновалентный элемент. Точно так же валентность азота может быть 3 (вспомним газ аммиак NH3) или 5, но иногда 1 и даже 6.
Валентность — характерное для нормального поведения элемента свойство, которое помогает запомнить и объяснить химические превращения, а также изобразить структурные формулы сложных молекул. Здесь мы дали только общепринятое и грубое представление о валентности. Современные химики различают несколько видов валентности, точнее, типов связей между атомами. Они объясняют эти связи электрическими силами, которые удерживают положительные и отрицательные ионы друг подле друга. В некоторых случаях такая связь возникает из-за того, что электроном совместно владеют два атома.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
С развитием химии, сопровождавшимся исследованием свойств элементов и измерением их атомных весов, а также свойств широких классов соединений, возникла потребность в некоторой общей упорядочивающей схеме. Создавшаяся ситуация чем-то напоминала ту, в которой оказывается юный коллекционер почтовых марок, когда он сталкивается с изобилием марок какого-либо государства. Если он догадается расположить их отдельными рядами друг под другом, так чтобы каждый ряд отвечал одинаковому году выпуска, а столбец — стоимости марки, то легко подметит некоторые общие для всех выпусков закономерности, скажем, что «все почтовые марки достоинством в 1 цент — зеленого цвета». Возможно, он не удержался бы от соблазна сделать и другие, иногда слишком поспешные выводы. Однако польза выбранной им системы заключается только в том, что она устанавливает определенный порядок. Химические элементы ставят перед нами гораздо более трудную, но и более важную задачу. Выстраивая их в порядке возрастания атомных весов, Менделеев (~ 1869 г.) и другие ученые увидели, что некоторые основные химические свойства элементов регулярно повторяются наподобие того, как каждый новый выпуск почтовых марок начинается с зеленой марки стоимостью в 1 цент. Однако химические свойства не столь очевидны, как цвета почтовых марок. Поэтому, коль скоро вы не изучали химию, это поразительное повторяющееся сходство, возможно, и не произведет на вас должного впечатления. Мы не будем пытаться вовлечь вас в дискуссию по вопросам химии, а просто расскажем о некоторых выводах, следующих из периодической системы, и приведем примеры действенности ее предсказаний. (См. таблицу, которая помещена двумя страницами ниже.)
Начнем с самых легких элементов: водорода (1), гелия (4), лития, бериллия, бора, углерода и т. д. в порядке возрастания атомного веса. Мы увидим перед собой последовательность абсолютно не схожих друг с другом легких элементов. Оставив в стороне простейшие из них — водород и гелий, — перейдем к ряду, содержащему восемь элементов. Элементы, идущие за ними, повторяют многие свойства этого ряда, поэтому следующие восемь элементов мы запишем во втором ряду, располагая его ниже первого, в результате чего получим столбцы «семейств» или групп элементов со сходными свойствами. Будем продолжать в том же духе, переходя ко все более тяжелым атомам и не всегда заканчивая ряд на восьмом элементе, а иногда удлиняя его, если это диктуется химическими свойствами[94].
После того как элементы разместятся в таблице, мы заметим, что «щелочные металлы» — литий, натрий, калий, рубидий, цезий и недавно открытый франций — окажутся в одном столбце. Все они мягкие, химически активные металлы, которые с жадностью вступают в реакцию с водой, вытесняя из нее водород и образуя едкие щелочные, мыльные на ощупь растворы. Атомы каждого из этих металлов одновалентны, т. е. имеют всего одну химическую связь и потому соединяются с одновалентным хлором, образуя хлориды, например хлористый натрий. С физической точки зрения эти металлы характерны тем, что позволяют получать хорошие светочувствительные поверхности, так как свет легко вырывает электроны из их атомов, и применяются для изготовления фотоэлементов (электронных глаз). В настоящее время мы считаем, что их химические и физические свойства тесно связаны между собой: электрон, который легко выбивается из атома под действием света, так же легко заимствуется другим атомом, например атомом хлора.
В середине первого столбца появляется вторая подгруппа, состоящая из менее активных металлов, которые перемежаются с металлами первой подгруппы. Здесь мы встречаемся с медью и такими «благородными» металлами, как серебро и золото. Второй столбец содержит уже металлы с валентностью 2, к которым относятся бериллий, кальций, барий, стронций и радий. Сульфаты этих металлов не растворимы в воде (например, CaSO4 — обожженный гипс, или алебастр, который используется также в качестве мела для классных досок, и BaSO4, хорошо поглощающий рентгеновские лучи и применяемый в медицине при просвечивании желудочного тракта). Здесь присутствует и вторая подгруппа — цинк, кадмий, ртуть (сульфаты которых уже растворимы), прежнему обладающая валентностью 2.
В правой части таблицы тоже имеется столбец с очень активными элементами, на этот раз уже неметаллами — фтором, хлором, бромом и йодом. Все они соединяются с водородом, образуя кислоты, все оставляют ожоги на коже, хотя в малых дозах хлор и йод могут быть полезны, так как обладают бактерицидным действием. Плотность и агрессивность этих элементов меняются вдоль столбца по мере возрастания атомного веса. Фтор представляет собой легкий желтоватый едкий газ, этакий необузданный злодей, который действует без разбора почти на любые вещества — от платины до человеческого тела. Хлор — это тяжелый зеленый ядовитый газ, который способен разрушить ваши гортань и легкие. Бром, самый яркий по окраске член семейства, — едкая красно-коричневая жидкость, легко превращающаяся в пары коричневого цвета, всегда готовый обжечь вам кожу, если вы посмеете к нему прикоснуться. И, наконец, йод — наиболее спокойный из них, который при комнатной температуре образует темные кристаллы, но легко возгоняется при нагревании, образуя фиолетовые пары. Каждый из этих элементов соединяется с калием, натрием, кальцием и любым другим металлом, образуя соли.
Элементы в столбцах, расположенных ближе к середине таблицы, не выказывают столь же очевидных для не химика общих свойств, но искушенный специалист тоже различит там строгую упорядоченность. Средний столбец начинается, как и другие, похожими друг на друга элементами — углеродом и кремнием. Оба эти элемента — неметаллы, их валентность равна 4, они образуют с водородом сходные соединения СН4 и SiH4, а с двухвалентным кислородом СО2 и SiO2 (песок). Но затем семейство как будто разделяется на две родственные линии — титан, цирконий, гафний в одной, и германий, олово, свинец в другой. Обе ветви в своих последующих поколениях все более приобретают металлические свойства.
Инертные газы — гелий, неон, аргон — даже не были известны в период создания периодической системы. Когда спустя примерно тридцать лет они были открыты, для них пришлось учредить отдельный столбец. Но, получив «прописку», они образовали специфическую группу, целое семейство химических тунеядцев — полностью инертных, не способных образовывать какие-либо соединения. Сейчас их принято называть «благородными газами». В отличие от водорода, кислорода и других газов, которые существуют в форме Н2, О2 и т. д., их атомы не способны даже соединяться в молекулы и проводят свою жизнь в одиночестве. Последнее утверждение на первый взгляд может показаться просто выдумкой. В самом деле, если эти газы не образуют химических соединений, если они позволяют себе игнорировать химию, то можно ли вообще установить их атомный вес и доказать, что он совпадает с молекулярным? И все же мы уверены, что это так.
Вы уже видели в гл. 30, как измерения удельной теплоемкости, опиравшиеся на надежную физическую теорию, позволяют твердо установить, что молекулы благородных газов содержат по одному атому.
Периодическая система химических элементов удобна не только для запоминания их свойств или выбора последовательности изучения, но обладает всеми достоинствами, присущими самым замечательным теориям и концепциям. Она позволила предсказать свойства еще не открытых элементов, для которых остались пустые клетки. Одновременно периодическая система ставит перед нами ряд новых проблем — от причин нарушения расположения элементов по возрастанию атомного веса[95] до кардинальных вопросов о структуре атомов, знание которой позволило бы объяснить саму периодичность свойств элементов.
Часть периодической системы элементов приведена на фиг. 168. Полную систему с более подробными объяснениями и поучительными описаниями поисков отсутствующих элементов, свойства которых она предсказывала и которые в конце концов заполнили ее пустующие клетки, вы найдете в учебниках химии.
Фиг. 168. Периодическая система элементов Менделеева.
АТОМНЫЕ НОМЕРА
Атомные номера в периодической системе химических элементов
Первоначально система химических элементов была составлена по возрастанию атомного веса. После того как такое расположение было признано удачным, казалось естественным присвоить каждому элементу порядковый номер, аналогично тому как поступает филателист, нумеруя по порядку свои марки[96].
С химической точки зрения эти номера очень удобны, и мы запишем их над каждым элементом нашей системы. (Из книг по химии вы узнаете, что эти номера имеют гораздо более глубокое значение: они соответствуют числу электронов в атоме. Однако это объяснение дается уже атомной физикой, и мы будем рассказывать о нем в последующих главах.) Таким образом, мы приписываем водороду номер 1, гелию номер 2… и так вплоть до элемента номер 92 — урана.
Длительное время мы не знали, считать ли уран последним элементом периодической системы или за ним существуют другие элементы. Сейчас мы уже научились получать элементы с номерами 93, 94 и т. д., бомбардируя атомными частицами тяжелые атомы. Возникла новая, «ядерная» химия, перспективы которой поразительны. Мы можем заглянуть еще дальше и предугадать свойства атомов, гораздо более тяжелых, чем любые известные нам сейчас. Как и атомы с номерами от 84 до 102, они будут нестабильны (радиоактивны), причем должны распадаться настолько быстро, что не стоит удивляться, если они вообще не существуют в природе[97].
Современные представления об атомном номере
В наши дни мы рассматриваем атомный номер как основную характеристику химического элемента. Мы знаем, что он представляет собой величину положительного электрического заряда атомного ядра, измеренную в единицах заряда электрона. Таким образом, атомный номер говорит нам, сколько электронов содержится в электрически нейтральном атоме. Распределение и энергия связи этих электронов зависят от заряда ядра, и поскольку поведение элемента определяется числом внешних электронов, которыми его атомы обмениваются в химических реакциях, то можно сказать, что химические свойства элемента зависят от заряда ядра, т. е. атомного номера. Внутренние электроны атома, крепко удерживаемые его ядром, почти не принимают участия в химических реакциях, за исключением разве лишь самых легких атомов, в которых число электронов невелико. Поэтому сближение атомов, происходящее при образовании химического соединения, не может создать силы, достаточные для того, чтобы заставить внутренние электроны заметно изменить свои состояния. Однако внутренние электроны ответственны за испускание и поглощение рентгеновских лучей. Если вырвать из атома внутренний электрон, например бомбардируя его другими атомными частицами, то как только соседний электрон займет его место, атом испустит рентгеновский квант, длина волны которого характеризует заряд атомного ядра. Таким образом, изучая рентгеновские лучи, испускаемые мишенями, изготовленными из различных элементов, мы можем определить атомный номер этих элементов. Поступая так, мы узнаем положение элемента в периодической системе, не прибегая к измерению атомных весов, и поэтому можем надеяться, что не обойдем ни одного из них. Для этого способа безразлично, находятся ли элементы в свободном состоянии или в соединении с другими. Он с абсолютной достоверностью дает нам атомный номер, т. е. заряд атомного ядра, свой для каждого элемента.
Атомы радиоактивных элементов неустойчивы, и хотя они обладают всеми свойствами, присущими отдельному элементу, — определенными химическим поведением, атомным номером и не обнаруживают никаких признаков делиться на еще более элементарные составные части, эти свойства сохраняются у них не вечно. Один за другим атомы радиоактивного элемента внезапно превращаются в атомы другого элемента. Спустя некоторое время количество первоначального (родительского) элемента сокращается за счет появления соответствующего количества другого (дочернего) элемента. Последний обладает всеми свойствами самостоятельного химического элемента (поэтому в свою очередь тоже может быть радиоактивным) и занимает соответствующее место в другом столбце периодической системы. В момент превращения атом выбрасывает мельчайшие осколки — альфа- и бета-частицы (а часто и гамма-лучи), обладающие колоссальной энергией. Излучение, или «радиация», таких частиц нестабильными атомами было первым обратившим на себя внимание свойством этих элементов, поэтому процесс самопроизвольного распада атомов и был назван радиоактивностью (см. гл. 39 и 43).
Альфа- и бета-частицы, вылетающие из атомного ядра, уносят электрический заряд, поэтому меняют заряд ядра, а следовательно, и атомный номер элемента, сдвигая его в другое место периодической системы. (С химической точки зрения причина, которая заставляет нас отнести новый атом к другому столбцу таблицы химических элементов, заключается в том, что с изменением заряда ядра меняется и его атомный номер, т. е. число и конфигурация атомных электронов, а следовательно, и химические свойства.)
Открытие радиоактивности могло бы заставить нас пересмотреть прежнее определение элемента как раз и навсегда неизменной простой субстанции, но нас спасает атомный номер. Атомный номер присущ только элементу; исследование любого соединения даст лишь атомные номера составляющих его элементов.
До начала нынешнего века казалось, что атомный вес столь же хорошо определяет химический элемент, как и атомный номер. Тщательный количественный химический анализ давал всегда одно и то же значение атомного веса элемента. Это казалось настолько естественным, что принималось как само собой разумеющееся. Затем оказалось, что атомный вес свинца, извлеченного из различных руд, немного различается. Могли ли существовать два сорта атомов свинца — легкие и тяжелые? Последующее изучение с помощью масс-спектрографов показало, что большинство элементов представляет собой смесь атомов с немного различающимися атомными весами. Атомные веса, полученные в результате химических измерений, являются средними значениями нескольких различных атомных весов, сложенных в пропорции, которая в окружающем нас мире, по-видимому, всегда остается неизменной. Что же представляют собой настоящие атомные веса? В какой степени их новые измерения спасают дискредитированную гипотезу Проута? Это мы увидим в последующих главах. Здесь же мы расскажем еще об одной причине, которая дает основания считать, что атомный номер лучше характеризует свойства элементов, чем атомный вес.
ЭЛЕКТРОЛИЗ
Электрохимия
Электрический ток легко проходит через водные растворы кислот, щелочей и солей, что говорит о существовании в таких растворах носителей тока. Как вы уже, наверно, догадались, этими носителями являются ионы, что по-древнегречески означает «несущий». В большинстве водных растворов даже небольшое напряжение без всякого труда и задержки вызывает электрический ток, поэтому можно думать, что ионы присутствуют во всем растворе и под действием приложенного электрического поля способны переносить заряды, создавая электрический ток. Мы знаем, что и в некоторых твердых кристаллах «+»- и «—»-заряды тоже сосредоточены на ионах, например кристалл хлористого натрия представляет собой кубическую решетку ионов Na+ и Сl-. Атомы натрия и хлора обменялись электроном и превратились в ионы, притяжение которых и обеспечивает устойчивость кристалла[98].
Будем последовательно пропускать электрический ток через несколько ванн с растворами, погрузив туда металлические проводники (электроды). В раствор сернокислой меди CuSO4 опустим медные электроды, в ванну с водой (+ кислота) — некорродирующие угольные или платиновые электроды, в ванну с соляным раствором — электроды специальной конструкции, позволяющие улавливать газообразные продукты и предотвращать их химическое взаимодействие с водой. По мере прохождения тока на каждом электроде выделяется некоторое количество вещества. Если пропускать ток вдвое дольше или удвоить силу тока, то количество полученного продукта тоже удвоится. Таким образом, масса вещества, выделившегося на каждом электроде, прямо пропорциональна произведению ток-время, или электрическому заряду, который прошел через ванну. Но масса каждого продукта определяет число выделившихся на электроде атомов, т. е.
ЧИСЛО АТОМОВ ~ ЭЛЕКТРИЧЕСКИЙ ЗАРЯД, ПРОШЕДШИЙ ЧЕРЕЗ РАСТВОР,
или
ЭЛЕКТРИЧЕСКИЙ ЗАРЯД ~ ЧИСЛО АТОМОВ.
Последнее утверждение означает, что существуют элементарные носители электрического тока — атомы или группы атомов, несущие некоторый постоянный заряд, так сказать «атомы» электричества верхом на атомах материи.
Далее, массы продуктов, появившихся на различных электродах под действием одинакового заряда, прошедшего через растворы, находятся в весьма многозначительных соотношениях. Так, если под действием электрического тока выделился 1 кг водорода, то тот же самый ток за то же самое время дает 23 кг натрия или 35,4 кг хлора или 108 кг серебра. Эти массы пропорциональны атомным весам продуктов. Следовательно, все они содержат одинаковое число атомов. Разделив массу продуктов на число атомов, мы узнаем массу отдельного атома, переносящего в каждом случае тот же самый заряд. При этом подразумевается, что ионы — это отдельные атомы, которые всегда несут равный электрический заряд, одинаковый для каждого атома элемента[99]. Мы используем такое представление, обозначая ионы знаками «+» и «—», соответствующими одному единичному электрическому заряду ((который, как мы теперь знаем, равен заряду электрона), т. е.
Н+ Na+ Сl- Ag+.
Однако, когда при электролизе воды выделяется 1 кг водорода, то одновременно получается 8, а не 16 кг кислорода, а в ванне с раствором сернокислой меди выделяется только 31,8 кг меди (с атомным весом 63,6). Это говорит о том, что либо тот же самый заряд переносится половинками атомов кислорода и меди, либо целые атомы этих элементов несут двойной заряд. Безусловно, мы должны выбрать вторую возможность. При этом ион меди приходится обозначать Си++. Для того чтобы пропустить через раствор одно и то же количество электричества, понадобится вдвое меньше таких ионов, чем, скажем, ионов водорода. (Мы пока подождем говорить об ионе О++. Кислород получается при электролизе как вторичный продукт, и настоящими носителями являются не ионы кислорода.) Заметим, что кислород и медь имеют валентность 2.
Возможно, что все ионы атомов с валентностью 2 несут двойной заряд. Измерение выхода кальция и цинка при электролизе растворов их солей подтверждает это предположение. Исследуем также алюминий, валентность которого 3, а атомный вес 27. Мы сможем убедиться, что тот ТОК∙ВРЕМЯ, который необходим для получения 1 кг водорода, даст не 27, а только 9 кг алюминия. Таким образом, ион алюминия — это Аl+++.
Некоторые ионы составлены из целой группы атомов. Вода, например, расщепляется на ионы Н+ и ОН-, каустическая сода — на ионы Na+ и ОН-, серная кислота — на Н+, Н+ и SO4-. Чистая вода бедна ионами, большая ее часть существует в виде молекул Н2О или составленных из этих молекул групп. Поэтому, чтобы облегчить электролиз воды, нужно обогатить ее ионами, например, добавляя туда H2SO4. Это значительно увеличивает содержание ионов Н+ и дает также много ионов SO4-. Когда ионы SO4- подходят к электроду, они отдают ему свои два отрицательных заряда и одновременно взаимодействуют с окружающими молекулами воды, образуя кислород и H2SO4, которая снова расщепляется на ионы[100]. То есть
H2SO4 —> H++ H++ SO4-,
SO4- —> SO4 + 2 заряда-,
H++ H+ —> H2 + 2 заряда+,
SO4 + H2O —> O + H2SO4,
H2SO4 —> H+ + H+ + SO4- и т. д.
Таким образом, кислота не расходуется, и по окончании длительного электролиза ее остается столько же, сколько было вначале, но количество воды уменьшается за счет появления водорода и кислорода.
Электролиз и ионы
При электролизе раствора сернокислой меди ионы Gu++ отдают отрицательному электроду свои заряды и осаждаются на нем (независимо от того, из чего он сделан), превращаясь в незаряженные атомы. Ионы SO4- идут к другому электроду и, если он изготовлен из меди, то взаимодействуют с ним, образуя сульфат меди. Таким образом, суммарный эффект состоит в том, что чистая медь просто-напросто переносится с одного электрода на другой, без какой-либо убыли сульфата меди. В результате один электрод омедняется, а с другого медь постепенно переходит в раствор.
Фиг. 169. Ионы, из которых составлены кристаллы поваренной соли, при растворении соли переходят в раствор.
Если к раствору приложено электрическое поле, то эти ионы становятся носителями электрического тока. (Изображение кристалла соли взято из статьи П. Р. Роуленда, опубликованной в Science News, № 15, март 1950 г.)
Итак, мы узнали, что растворы кислот, солей и т, и, содержат ионы, например,
Когда к таким растворам подводится постоянное напряжение, то создается электрическое поле, заставляющее ионы двигаться через раствор. Ионы с зарядом «+» движутся в обычном для электрического тока направлении (от «+» к «—»). Ионы с зарядом «—» перемещаются в обратном направлении. Перенос электрического тока осуществляется обоими типами зарядов. Если хотите, движение этих зарядов и есть электрический ток. Увлекаемые электрическим полем ионы дрейфуют в противоположных направлениях (чаще всего с различной скоростью), одновременно участвуя в хаотическом движении молекул воды. (Вблизи электрода электрическое поле очищает раствор от ионов одного знака, и ионы другого знака вынуждены спешить, чтобы самим осуществить весь электрический ток.) Поскольку каждый из ионов обязательно достигает своего электрода, то в конце концов его заряд нейтрализуется (фактически ион теряет лишние или приобретает недостающие электроны). Заряд уходит дальше по электрической цепи, а образовавшиеся незаряженные атомы вступают в контакт с водой и металлическим электродом и ведут себя так, как им велит их химическая природа. Например, ионы меди (которые в растворе имеют голубой цвет), попадая на электрод, захватывают два электрона и превращаются в два атома красной меди, прочно пристающие к электроду. В отличие от них ионы натрия, становясь нейтральными атомами металлического натрия, взаимодействуют с водой, вытесняя из нее водород и образуя щелочь едкий натр.
Законы Фарадея
Большей части наших сегодняшних представлений об ионах и электролизе мы обязаны Майклу Фарадею, который получил их практически из ничего, на самой заре экспериментов с электрическими токами. В серии замечательных опытов, основанных на точном предвидении, он изучил явления, происходящие при электролизе (которому он и дал это название), и свел все их разнообразие к двум простым законам, впоследствии заслуженно получившим его имя. Открытые им законы (~ 1833 г.) можно сформулировать следующим образом:
I. Независимо от состава раствора и материала электродов масса вещества, образованного на электродах, прямо пропорциональна произведению ток время, или количеству электричества.
II. При одинаковом количестве электричества масса вещества, полученного на различных электродах, пропорциональна
ХИМИЧЕСКОМУ ЭКВИВАЛЕНТУ ВЕЩЕСТВА, т. е.~ АТОМНЫЙ ВЕС / ВАЛЕНТНОСТЬ
Ионы в растворе
Имеются убедительные свидетельства того, что участвующие в электролизе ионы возникают в растворе сразу, и растворенные молекулы не ждут, пока их разобьет на части электрическое поле, которое мы прикладываем к раствору, чтобы пошел электрический ток. Это доказывается следующими наблюдениями:
1) Чтобы начался электролиз, достаточно лишь небольшого постоянного напряжения. (Некоторое дополнительное начальное напряжение связано с эффектом обратного тока, который создается продуктами электролиза, образующими мельчайшие источники электрического тока около электродов. При электролизе раствора сернокислой меди с медными электродами такого эффекта не обнаруживается, и ток следует закону Ома, однако если электроды изготовлены из инертного материала, например платины, то эффект существует. Он проявляется также и при электролизе воды. См. опыты 17 и 18 в гл. 32.)
2) Когда мы пытаемся измерить молекулярный вес растворенной соли (по ее «осмотическому давлению» или изменению точки замерзания раствора), мы замечаем, что растворенных частиц стало почти вдвое больше по сравнению с тем, чего можно было бы ожидать, если бы молекулы оставались целыми. Это говорит о том, что они расщепились на ионы. С другой стороны, для растворов, которые не проводят электрического тока, например растворов сахара, молекулярный вес растворенного вещества получается нормальным, потому что оно не образует ионов.
3) Такое утверждение хорошо согласуется с известными химическими свойствами вещества. Выпадение твердого осадка или образование газа, пузырьками выходящего наружу, как мы себе представляем, происходит в результате встречи ионов противоположного знака, которые нейтрализуют друг друга и соединяются с образованием продукта, уходящего из раствора. Ионы — это активные посредники большинства химических реакций, происходящих в растворах.
Число Фарадея и отношение е/М для ионов
Измерения показывают, что для получения 1,008 кг водорода необходимо 96 500 000 кулон электричества. Тот же самый заряд дают 35,4 кг хлора, (16,00/2) кг кислорода или (63,6/2) кг меди. (Количество электричества, необходимое для получения одного химического эквивалента вещества, выраженное в граммах, мы называем числом Фарадея или сокращенно «фарадеем», а если масса вещества выражена в килограммах, то «килофарадеем».)
Рассчитаем отношение заряд/масса для одного иона водорода (протона), предполагая, что все они одинаковы:
е/М = 96 500 000/1,008 = 95 700 000 кулон/кг
Отношение заряда к массе для иона меди равно
3 034 000 кулон/кг.
(Обратной величиной: 0,000 000 329 кг меди/кулон мы уже пользовались в гл. 32, когда давали определение ампера.)
Ионы, электроны и периодическая система химических элементов
Забегая вперед в область физики, занимающейся моделями атома, набросаем здесь схему простой теории атома. Мы представляем атомы в виде облака электронов, окружающего центральное ядро, с которым внутренние электроны очень сильно, а внешние более слабо связаны электрическими силами. Атомы элементов первого столбца периодической системы (литий, натрий и т. д.) имеют один слабо связанный электрон, который с легкостью переходит к другим атомам. Этот электрон бóльшую часть времени проводит вне компактной группы внутренних электронов, сконцентрированных ближе к ядру. Именно такая компактная группа окружает ядро атомов элементов, принадлежащих нулевому столбцу. Там нет электронов, которые можно легко вырвать из атома, а следовательно, нет и способности образовывать ионы, нет и химических соединений. Элементы первого столбца охотно отдают свой единственный внешний электрон, и их атомы участвуют в химических реакциях в виде однократно заряженных ионов. Если эти элементы находятся в твердом состоянии и к ним прикладывается электрическое поле, то такие электроны практически беспрепятственно переходят от атома к атому, создавая электрический ток. Поэтому можно ожидать, что элементы первой группы будут хорошими проводниками. И действительно, все элементы первого столбца — металлы, очень хорошие проводники электричества.
Атомы элементов второго столбца имеют по два внешних электрона, не входящих во внутреннюю стабильную группу, теряя которые, они становятся ионами ++. Эти элементы также являются металлами и хорошо проводят электрический ток.
Теперь напрашивается новое объяснение столбцов периодической системы. Номер столбца отвечает валентности, т. е. числу слабо связанных внешних электронов. Посмотрев на алюминий, находящийся в третьем столбце таблицы и имеющий ионы Аl+++, мы можем ожидать, что он имеет три внешних электрона.
Обращаясь к седьмому столбцу, мы не будем говорить, что входящие в него элементы обладают семью слабосвязанными внешними электронами, а скажем, что здесь имеется почти замкнутая инертная группа, похожая на те, которые окружают атомы элементов нулевого столбца. И в самом деле, характер электронного облака атомов элементов седьмого столбца таков, что требуется еще только один электрон, чтобы образовалась замкнутая группа. Поэтому не нужно удивляться, что фтор, хлор и другие элементы этого семейства с готовностью отбирают электрон (у натрия, воды и почти у всех других веществ), образуя отрицательные ионы. Откуда мы знаем, что для образования замкнутой группы достаточно одного добавочного электрона? Чтобы понять это, взгляните на нулевой столбец, который находится в преддверии седьмого столбца.
Все эти причины заставляют нас рассматривать валентность как меру сродства атомов к электронам. Например, электрон атома натрия захватывается хлором, и образуется ионная молекула Na+—Cl-. Оба эти иона, если забыть об их избыточном электрическом заряде, очень похожи на атом инертного газа. Именно поэтому мы и наблюдаем сильное притяжение, придающее кристаллам прочность, сильные ионные свойства, но не обнаруживаем тенденции к повторному обмену электронами, который мог бы дать новые химические свойства.
Задача
Что, по вашему мнению, происходит с атомами кальция и хлора при соединении их в хлористый кальций, если основываться на представлении об образовании устойчивых электронных групп при обмене атомов электронами?
Притяжение между ионами — это не единственная форма химической связи. В некоторых соединениях такая связь осуществляется за счет того, что несколько атомов совместно владеют одним или более электронами, находящимися между ними. Чтобы объяснить происхождение валентности такого типа и предсказать саму ее возможность, необходимо привлечь современную квантовую теорию, или «волновую механику».
«Физическая» связь между отдельными молекулами тоже возникает благодаря смещению электронов одной молекулы под действием электрического поля другой, в результате чего заряды молекул «раздвигаются» [+… —] и молекулы поляризуются. Затем они поворачиваются и сближаются таким образом, что заряд одной молекулы оказывается вблизи заряда противоположного знака другой молекулы, а возникающие при этом силы притяжения обеспечивают устойчивость связи. Механизм такого взаимодействия также описывается квантовой теорией.
Молекулы воды
При растворении солей в воде ионы, по-видимому, образуются очень охотно, но нет даже намека на то, что они возникают в таких растворителях, как, скажем, бензол. Мы считаем, что сама молекула воды, которая может образовать ионы Н+ и ОН-, электрически поляризована и имеет на одном конце заряд «-+-», а на другом «—».
Известно, что водяные пары легче конденсируются на электрически заряженных частицах. Особенно легко капли тумана образуются на ионах газов (см. гл. 39, где описано, как это свойство используется в камерах Вильсона для исследования атомных частиц). Известно также, что если поместить воду между пластинами электрического конденсатора, то его емкость, т. е. способность накапливать электрический заряд от присоединенной к нему батареи, увеличивается в 81 раз. Это происходит потому, что поляризованные молекулы воды поворачиваются в электрическом поле, частично компенсируя его своим собственным полем. При растворении соли в воде молекулы последней помогают образованию ионов, скапливаясь вокруг них таким образом, что к иону направлены заряды противоположного ему знака. Каждый ион собирает вокруг себя целую гроздь молекул воды, которая тащится за ионом, сильно затрудняя его движение. Вот почему ионы так медленно перемещаются в электрическом поле.
Как увидеть движение ионов
Ионы, так же как и атомы, столь малы, что разглядеть их невозможно, но мы можем увидеть, как они движутся в электрическом поле, по изменению окраски раствора. Поместим немного голубых ионов Си++ или желтых хромат-ионов в раствор с бесцветными ионами (чтобы приостановить перемешивание из-за конвекции, добавим немного желатина, который, однако, не мешает электрическому току и движению ионов). Когда мы наложим электрическое поле, то окрашенное пятно начинает очень медленно перемещаться — со скоростью около миллиметра в минуту. Здесь мы воочию наблюдаем движение настоящих ионов — сгустков заряженных атомов.
ОРГАНИЧЕСКАЯ ХИМИЯ
Химия углерода. Органические соединения
Углерод, обладающий валентностью 4, обнаруживает замечательную способность соединяться с элементами, расположенными по обе стороны среднего столбца периодической системы, где он помещается, и даже со своими собственными братьями — другими атомами углерода. Он соединяется с водородом, образуя метан СН4, с хлором, образуя ССl4, а также с кислородом, азотом, серой и т. д. Легко образуются целые цепочки углеродных атомов, присоединивших водород. Так, из метана получаются этан (газ)… октан (жидкость, входящая в состав бензина)… и еще более длинные цепочки, отвечающие твердым веществам (например, парафин).
В частности, эти формулы позволяют понять, почему мы часто встречаемся с химическими соединениями, обладающими одинаковым количеством атомов С, Н и т. д., но различными химическими свойствами. Они даже дают нам способы различить, с какой разновидностью мы имеем дело в данном образце. Во многих органических веществах водород, входящий в состав углеводородной цепочки, может замещаться хлором. Возможно и образование боковой цепочки при замещении одного атома водорода атомом углерода, входящим в эту цепочку. Кроме того, соседние углеродные атомы могут соединяться, используя не одну, а две или три связи, как, например, в ацетилене H — C C — H
Если в состав соединения входит кислород, то, обладая валентностью 2, он забирает у углерода две связи. Атом кислорода также может встать в цепочку между углеродом и водородом. Так, при замене в этане крайнего атома водорода радикалом — О — Н получается спирт СН3СН2ОН, формула которого напоминает щелочь, но который не обладает щелочными свойствами.
Если вместо двух атомов водорода ввести в спирт еще один атом кислорода, удерживаемый двумя связями, то мы получим уксусную кислоту с характерным для всех органических кислот кислотным остатком СООН.
Атомам углерода удобно соединиться в кольцо, которое обычно содержит шесть атомов в виде симметричного шестиугольника, как, например, в бензоле С6Н6.
(На фиг. 172, а каждый атом углерода одной связью соединен с атомом водорода и две связи использует для того, чтобы образовать кольцо. Если вам покажется, что четвертая связь осталась без дела, вы можете либо употребить ее, чередуя в кольце одиночные и двойные связи, либо считать это дефектом плоской модели.) Существование углеродного кольца, содержащего 6 атомов, убедительно подтверждается опытами по замещению водорода в бензоле другими атомами. Если вы поверите в то, что структурная формула бензола действительно представляет собой кольцо, то это поможет вам ответить на вопросы, подобные следующим.

Задача
Обрабатывая бензол хлором, можно получить хлорбензол С6Н5Сl, бензол С6Н4Сl2 и трихлорбензол. Можно выделить эти три различных вещества и выбрать из них то, анализ которого показывает, что оно является бензолом. В этом соединении 2 атома водорода замещены хлором, однако его химические и физические свойства существенно зависят от расположения атомов хлора в кольце. На фиг. 172, б показаны два различных расположения, одно из которых симметрично, а другое существенно асимметрично. В действительности известно несколько различных дихлорбензолов. Один из них — парадихлорбензол продается как средство против моли.
а) Сколько, по вашему мнению, существует различных дихлорбензолов?
б) Химики могут поверить вашему предсказанию и даже установить, который из возможных дихлорбензолов имеется в чистом образце, поступив следующим образом. Сначала обработают его хлором, чтобы превратить в трихлорбензол. Затем узнают, сколько различных трихлорбензолов имеется в конечном продукте. Нарисуйте структурные формулы для каждого из дихлорбензолов, которые вы нашли, решая задачу а). Укажите, сколько различных трихлорбензолов вы ожидаете получить при добавлении к каждому из полученных дихлорбензолов по одному атому хлора.
Органическая и неорганическая химия
Многие из описываемых соединений углерода найдены в живой материи, а наиболее сложные из них были получены только из растений и организмов животных. Поэтому раздел химии, который изучает эти вещества, был назван органической химией. Сейчас мы знаем, что углерод способен образовать бесчисленное множество соединений, многие из которых оказались очень полезными, и за всеми ними мы сохраняем это название. Органическая химия не менее важна и разнообразна, чем химия других соединений, которую мы называем неорганической.
Современная органическая химия далеко ушла от таких простых веществ, как спирт, уксусная кислота и т. п. Она занимается анализом и синтезом, раскрывает формулы соединений и создает их в лаборатории. Она дает нам растворители, красители, мыло, пластмассы, лекарства и другие полезные вещества с молекулярным весом, достигающим сотен и даже тысяч. Ученые видят успехи органической химии не только в обилии полученных ею соединений, но также в блестящем подтверждении логики ее аргументации, которая скрывается за проделанной работой. Сейчас органическая химия занимается белками пищи и живой материи с молекулярным весом, доходящим до 35 000. Состав этих белков уже известен, так что можно написать для них общую формулу, но работа по разгадке архитектуры их структурных формул еще продолжается.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК