Глава 25. Великая теория — кинетическая теория газов
«Поистине это загадочно, — заметил Ватсон. — Как выдумаете, что бы это могло означать?»
«Пока у меня нет фактов, — сказал Холмс — Строить же теорию, не имея фактов — большая ошибка. Невольно начинаешь подгонять факты под теорию вместо того, чтобы объяснять теорией факты».
А. Конан Дойль, «Шерлок Холмс»
Теория всемирного тяготения Ньютона приобрела мировую известность. Его «Принципы» выдержали три прижизненных издания. Популяризация книги стала модной при королевских дворах Европы. Объяснение «Принципов» для широкого круга читателей написал сам Вольтер. Была издана даже «Теория Ньютона в изложении для дам». На образованных людей теория Ньютона произвела впечатление не только способностью блестяще навести порядок «на небеси», но и тем, что она явилась предвестником грядущих великих открытий. Мы считаем теорию Ньютона правильной, ибо она оказалась простой, плодотворной и связала воедино множество различных явлений, дав людям глубокое понимание.
Теория проста, ибо основана на ряде четких утверждений. Эта простота не нарушается тем, что получение некоторых выводов требует использования сложной математики. Успех теории Ньютона породил попытки создать другие теории, в основе которых лежали бы также законы движения. Например, очень простым кажется поведение газов. Нельзя ли построить такую теорию, которая «предсказывала» бы закон Бойля и приводила бы к другим следствиям, обогащая наше понимание?
Такие попытки привели к созданию кинетической теории газов. Суть ее заключается в идее, которая, если вдуматься, как и большинство великих открытий, довольно проста: давление газа есть результат бомбардировки стенок мельчайшими частичками, «молекулами», газа. Газы обладают простыми свойствами. Они всегда заполняют сосуд и в отличие от твердых тел или жидкостей оказывают одинаковое давление на все стенки сосуда. При постоянной температуре произведение (давление)х(объем газа) остается постоянным независимо от того, сжат ли газ или разрежен. Нагревание газов увеличивает либо их давление, либо объем, либо и то и другое, но происходит это у всех газов одинаково. Газы подвижны, легко проникают друг в друга и просачиваются через поры в стенках. Можно ли «объяснить» эти свойства на основе механической картины? Последователи Ньютона возродили идею греческих философов о том, что вещество состоит из «атомов огня», находящихся в постоянном движении. Теперь, вооруженные механикой, они могли придать этой картине реальный смысл и выяснить, на что же способны «атомы». Наиболее поразительным свойством, которое смогла объяснить такая теория, был закон Бойля.
Закон Бойля
В 1661 г. Бойль «не без удовлетворения и восхищения» объявил о сделанном им открытии — давление и объем находятся «в обратной пропорции». Этим он хотел сказать: (давление)~(1/объем) или при сжатии воздуха произведение (давление)х(объем) остается постоянным. Тот факт, что воздух при нагревании расширяется, был хорошо известен, так что необходимость оговорки «при постоянной температуре» была очевидна. Так Бойль открыл «воздушную пружину» — пружину, которая в отличие от твердой пружины Гука обладает переменной жесткостью.
В лаборатории вам, вероятно, приходилось знакомиться с «опытом Бойля» на примере сухого воздуха, но это делалось не для того, чтобы «открыть» известный закон, а в качестве упражнения для проверки вашего «искусства в обращении с природой». Вы были ограничены малыми изменениями давления (скажем, от 1/2 до 2 атм), и точность лимитировалась колебаниями комнатной температуры и конусообразностью стеклянного цилиндра, содержащего газ[123]. Если отложить на графике зависимость давления от объема, то окажется, что точки лягут на гиперболу. Однако трудно быть уверенным, что получилась именно гипербола, и считать, что мы подтвердили закон Бойля[124]. Поэтому лучше откладывать зависимость давления от 1/объем и искать прямую линию, проходящую через начало координат.
Измерения, проведенные Бойлем, не были очень точны и ограничивались давлением от доли атмосферы до 4 атм. Если вы проведете более точные измерения, то обнаружите, что pV меняется лишь на десятые доли процента. На вашем графике зависимости р от 1/V экспериментальные точки лягут весьма близко к теоретической прямой, проходящей через начало координат.
Поскольку (масса)/(объем) есть плотность, а масса постоянна, то величина 1/V характеризует плотность, и закон Бойля гласит:
ДАВЛЕНИЕ ~ ПЛОТНОСТЬ
В этом и состоит смысл следующего утверждения элементарной теории газов: «если поместить в ящик вдвое больше молекул, давление увеличится ровно вдвое».
Фиг. 1. Закон Бойля.
При проверке закона Бойля все измерения делаются при одной и той же температуре, т. е. линии на графике являются изотермами. Разумеется, на одной диаграмме мы можем изобразить несколько изотерм, как на фиг. 2.
Фиг. 2. Изотермы (закон Бойля).
Однако с расширением области давлений наблюдаются заметные отклонения от закона Бойля. Этот закон лишь приближенно описывает поведение реальных газов. Он оказывается точным при малых давлениях и нарушается при больших, когда газ сжимается до высокой плотности. На фиг. 3 показаны экспериментальные данные при давлениях вплоть до 3000 атм. (Графики, описывающие поведение СО2 вплоть до ожижения, приведены в гл. 30.)
Фиг. 3. Отклонения от закона Бойля для воздуха при комнатной температуре.
Кривые дают зависимость давления от объема для идеального газа, подчиняющегося закону Бойля. Точки показывают поведение воздуха и при малых давлениях неотличимы от кривых. Масштаб по горизонтальной оси растягивается в 10 раз, а по вертикальной оси сжимается в 10 раз.
Теория
Бойль пытался угадать механизм, лежащий в основе его закона. Будучи хорошим химиком, он представил себе, что закон обусловлен поведением крохотных частичек. Частички газа, думал он, сопротивляются давлению, подобно груде маленьких шариков свалявшейся шерсти. Ньютон пошел дальше и вычислил силу отталкивания, необходимую для объяснения закона Бойля. Затем Д. Бернулли опубликовал свою теорию, которая предсказывала закон Бойля, не используя каких-либо специальных сил. Он показал, что движущиеся частицы, бомбардируя стенки сосуда, должны производить давление; он предположил также, что нагревание газа заставляет частицы двигаться быстрее. Это было началом современной теории. Попытка была смелая, но рассмотрение оказалось неполным. Лишь спустя столетие, в 1840 г., Джоуль и другие создали «кинетическую теорию газов», в основе которой лежало следующее утверждение:
Газ состоит из мельчайших упругих частиц, находящихся в быстром движении, а давление газа на стенки есть просто результат бомбардировки их этими частицами.
Джоуль показал, что такая теория может «объяснить» закон Бойля и дает важные сведения о самих частицах газа. Вскоре эта идея благодаря усилиям математиков и физиков превратилась в блестящую теорию, которая обогатила наше миропонимание.
Движущиеся частицы газа мы называем молекулами. Название это пришло из химии, где оно означает мельчайшие частицы вещества, которые могут еще существовать самостоятельно. Расщепите молекулу и вы получите отдельные атомы, свойства которых будут отличаться от свойств первоначального вещества. Так, молекула воды, Н2О, дает два атома водорода и один кислорода, свойства которых отличны от свойств молекулы воды. Предоставленные самим себе отдельные атомы группируются в пары Н2 и О2 — молекулы газов водорода и кислорода. В кинетической теории газов мы имеем дело с молекулами и предполагаем, что они не расщепляются при соударениях. Кроме того, мы считаем, что молекулы действуют друг на друга лишь в момент соударения; когда они оказываются достаточно близко друг к другу, они испытывают действие отталкивающей силы, но на очень короткое время. В этом фактически и заключается соударение.
Теперь вы имеете все необходимое для построения кинетической теории газов. Попытайтесь сделать это. Предположите, что давление газа обусловлено упругими ударами молекул в стенки сосуда. Первый этап состоит в проработке задач 1 и 2. Они начинаются со столкновений шариков и кончаются бомбардировкой молекулами, и это позволяет предсказать поведение газов. После того как вы осилите задачи, возвращайтесь к обсуждению деталей.
Приведенные ниже задачи помогут вам построить кинетическую теорию газов.
Успех планетарной теории Ньютона стимулировал попытки построить другие теории, основанные на ньютоновых законах движения и ряде очевидных предположений. Теория газов рассматривает газ как скопление мельчайших молекул, очень часто сталкивающихся друг с другом. Приписывая молекулам некоторые простые свойства (включая основное предположение, что они существуют!) и допуская, что к ним применимы законы движения Ньютона, удалось вывести (предсказать) закон Бойля и многие свойства газов. Как и в большинстве теорий, для получения выводов мы на основании неких предположений должны проделать ряд вычислений. Чтобы облегчить эти вычисления, вам предлагается серия задач о столкновении шарика. Они подведут вас к вычислениям, которые дадут ценные предсказания. Основные вычисления могут показаться сначала трудноватыми просто потому, что они относятся к таинственным молекулам, но если, проделав вычисления, вы на время оставите их, то вскоре убедитесь, что они были вполне осмысленными.
Задача 1
I. Обмен импульсом (количеством движения)
Шарик массой 2 кг, двигаясь со скоростью 12 м/сек, ударяется под прямым углом в массивную стенку и останавливается.
1) Импульс шарика до соударения равен ___.___ (единиц)
2) Импульс шарика после соударения равен ___.___ (единиц)
3) Изменение импульса шарика равно ___.___ (единиц)
4) Если третий закон Ньютона, который управляет соударением тел, верен и применим в этом случае, то мы можем сказать, что изменение импульса стенки (и того, с чем она скреплена) должно быть ___.___ (единиц)
II. Сила, которую оказывают ударяющие о стенку шарики
Предположим, что о стенку ударяется множество шариков массой 2 кг каждый, движущихся со скоростью 12 м/сек. Пусть в течение 10 сек о стенку ударяются и останавливаются 1000 таких шариков. Каково будет оказываемое ими давление на стенку?
Фиг. 4. Сосуд содержит шарики или молекулы, которые движутся взад и вперед между стенками и своими ударами создают давление.
Вычисляется давление на переднюю стенку.
Полное приращение импульса стенки (за период 10 сек) равно ___.___ (единиц)
(Примечание. На самом деле изменение импульса происходит скачкообразно, один скачок за каждый удар шарика о стенку, но можно вычислить полное приращение импульса и, используя его, подсчитать среднюю силу, т. е. силу, усредняющую эти скачки за весь период 10 сек. Чтобы найти величину этих скачков, необходимо знать время, которое требуется шарику, чтобы потерять свой импульс, другими словами, — длительность отдельного соударения. Это время не дано, так что можно вычислить только среднюю величину силы.)
Средняя сила, действующая на стенку в течение 10 сек из-за потери 1000 шариками своего импульса, находится из формулы F∙t = Δ(mv). Средняя сила, F, действующая на стенку, должна быть равна ___.___ (единиц)
(Заметьте, что соотношение F∙t = Δ(mv). есть не что иное, как второй закон Ньютона. Поэтому используемые в нем силы должны выражаться в абсолютных единицах, как и в законе F = m∙a, т. е. в ньютонах.)
III. Сила, действующая на стенку при ударе упругих шаров
Предположим, что, как и в предыдущей части задачи, 1000 шариков массой 2 кг каждый в течение 10 сек падают на массивную стенку перпендикулярно ее поверхности, но на этот раз они отскакивают назад с той же скоростью 12 м/сек.
1) Импульс каждого шарика до соударения ___.___ (единиц)
2) Импульс каждого шарика после соударения ___.___ (единиц)
(Помните, что импульс есть вектор. Не забывайте знаков + и —!)
3) Приращение импульса одного шарика равно ___.___ (единиц)
4) Изменение импульса стенки равно ___.___ (единиц)
(Примечание. Ответ не будет равен нулю.)
5) Если в течение 10 сек о стенку ударяется и отскакивает, 1000 шариков, то полное изменение импульса стенки равно ___.___ (единиц)
6) Средняя сила, действующая на стенку на протяжении 10 сек, равна ___.___ (единиц)
7) Если все 1000 шариков ударяются об участок стенки высотой 2 м и шириной 3 м, то среднее давление (= сила/площадь) на этом участке равно ___.___ (единиц)
IV. Движение внутри ящика
Прежде чем заменить упругие шарики молекулами, мы должны поместить их в закрытый ящик. Возьмем продолговатый ящик длиной 4 м с единственным шариком внутри, который движется из конца в конец со скоростью 12 м/сек. Он ударяется перпендикулярно каждой из стенок и со скоростью 12 м/сек отскакивает в противоположную сторону. Теперь уже один и тот же шарик будет ударяться о каждую стенку много раз за 10 сек. Вместо того чтобы брать число шариков, ударяющихся о стенку, мы можем воспользоваться числом ударов, производимых одним шариком. Для нахождения силы, действующей на стенку, нужно считать удары только об эту стенку.
1) Между двумя последовательными ударами о стенку ящика шарик проходит расстояние туда и обратно, т. е. от передней стенки к задней и от задней к передней. Таким образом, он проходит ___ м.
2) При скорости 12 м/сек полное расстояние, пройденное шариком за 10 сек, равно ___ м.
3) Сколько раз шарик пройдет туда и обратно за 10 сек?
4) Сколько раз шарик ударится о переднюю стенку за 10 сек?
Таким образом, для получения 1000 ударов за 10 сек в ящике должно быть несколько шариков. На самом деле нужно примерно ___ шариков.
5) При каждом ударе о переднюю стенку импульс каждого шарика изменяется на ___.___ (единиц)
6) За 10 сек шарик ударяется ___ раз о переднюю стенку ящика, и при каждом ударе импульс меняется на ___.___ (единиц)
Полное приращение импульса передней стенки ящика за 10 сек равно ___.___ (единиц)
Полная сила, действующая на переднюю стенку в течение 10 сек, равна ___.___ (единиц)
(Давление определяется как сила/площадь, так что, если известна площадь, можно вычислить давление (среднее), вызванное ударами шарика. В нашем случае нет смысла вычислять давление, оказываемое одним шариком, можно проделать аналогичные вычисления для молекул и предсказать таким образом, давление газа.)
Теперь проведем аналогичные вычисления для молекул газа в сосуде.
Позднее мы повторим их с помощью алгебры (задача 2).
V. Молекулы газа в сосуде
Металлический сосуд длиной 4 м со стенкой 3 м х 2 м содержит одну молекулу газа, которая движется взад и вперед вдоль сосуда со скоростью 500 м/сек, упруго отскакивая от его стенок. Молекула приближается к одной стенке, ударяется о нее и, отразившись, летит с той же скоростью к другой стенке, снова ударяется и опять отскакивает с прежней скоростью 500 м/сек. Масса молекул примерно равна 6∙10-26 кг.
(Примечание. Простые химические измерения показывают, что молекулы кислорода и азота (в воздухе) приблизительно в 30 раз тяжелее атома водорода. Сложные физические измерения говорят нам, что масса атома водорода равна 1,67∙10-27 кг.)
1) При ударе о переднюю стенку и отскоке импульс молекулы изменяется на ___.___ (единиц)
2) За 10 сек молекула проходит расстояние ___ м,
3) Между двумя последовательными соударениями о переднюю стенку молекула успевает долететь до другой стенки и вернуться назад, т. е. пройти расстояние ___ м.
4) В течение 10 сек молекула ___ раз пролетит туда и обратно и, следовательно, совершит такое же число ударов о переднюю стенку.
5) За 10 сек молекула раз ударится о переднюю стенку, изменяя свой импульс при каждом ударе на ___.___ (единиц)
6) Полное изменение импульса передней стенки за 10 сек равно ___.___ (единиц)
7) Средняя сила, действующая на протяжении 10 сек на переднюю стенку сосуда, равна ___.___ (единиц)
8) Давление равно (сила/площадь). Стенка имеет площадь 2 х 3 м2. Среднее давление на стенку равно ___.___ (единиц)
VI. Множество молекул в сосуде
1) Предположим теперь, что сосуд содержит 6∙1026 молекул (600 000 000 000 000 000 000 000 000). Это приблизительно соответствует реальному числу молекул в таком сосуде, если наполнить его воздухом при атмосферном давлении[125]. В действительности же они хаотически движутся во всех направлениях, но для упрощения вычислений примем, что они рассортированы на три независимые группы, причем одна группа летает вверх — вниз, другая направо и налево, а третья — взад и вперед. Из соображения симметрии молекулы должны быть поровну распределены между тремя группами (фиг. 5). Давление на переднюю стенку сосуда обусловливается только ударами молекул, движущихся взад и вперед. Продолжим вычисление давления, учитывая только треть всех молекул в сосуде, т. е. 2∙1026, или 200 000 000 000 000 000 000 000 000 молекул, которые движутся со скоростью 500 м/сек вдоль 4-метрового сосуда, ударяются о его переднюю стенку, отскакивают со скоростью 500 м/сек, ударяются о заднюю стенку, отскакивают и так далее.
Используя результат части IV задачи, мы можем показать, что среднее давление на стенку сосуда будет равно ___.___ (единиц)
(Эти данные описывают поведение воздуха в комнате. Какую величину атмосферного давления в тех же самых единицах показывает барометр?)
Каково отношение вычисленного выше давления к атмосферному, измеренному в лаборатории?
2) Предположим, что передняя и задняя стенки сосуда сблизились так, что длина сосуда сократилась до 2 м (т. е. до половины первоначальной длины) без изменения числа молекул, их скорости и площади этих стенок.
Среднее давление на переднюю стенку равно ___.___ (единиц)
(Примечание. Арифметика в п. 2 почти та же, что и в п. 1. Решите и получите новый ответ.)
а) Вычислите давление р.
б) Вычислите произведение (давления)х(объем), умножив р на abc.
в) Повторите все решения с помощью алгебры. Возьмите сосуд длиной a, шириной b и высотой с, содержащий N молекул, движущихся со скоростью v м/сек.
Фиг. 5. К задаче 1.
Вместо случайных направлений движения, как изображено здесь (а), потребуем, чтобы были три группы (б) по 2∙1026 молекул, движущихся параллельно граням сосуда. Теперь предположим, что давление на переднюю стенку создается ударами одной группы молекул (2∙1026), движущихся взад и вперед (в).
Задача 2. Кинетическая теория газов (алгебра)
(Рассмотрим поведение молекул в сосуде на основе алгебры. К задаче следует приступать после того, как сделана и проверена задача 1.)
Предположим, что в сосуде заключено N молекул (N молекул во всем сосуде, а не в каждом кубическом метре). Пусть длина сосуда равна а м, а размер передней и задней стенок Ь x с м2. В процессе хаотического движения со множеством соударений молекулы обмениваются импульсами и скорость их не остается постоянной. Однако мы полагаем, что если температура поддерживается постоянной, то их скорость близки к некой средней скорости, которую мы обозначим через v м/сек. Чтобы вычислить давление на стенку сосуда, мы должны учитывать только удары об эту стенку. Таким образом, для упрощения задачи мы считаем, что N молекул подразделяются на три равные группы, одна из которых движется вверх и вниз, другая влево и вправо, а третья — взад и вперед.
При вычислении давления на переднюю стенку мы учитываем только последнюю группу. Из соображения симметрии все N молекул должны разделиться между этими тремя группами поровну. Приняв эти предположения, ответьте на следующие вопросы, считая, что масса одной молекулы равна m кг.
1) При лобовом ударе молекулы о переднюю стенку и отражении изменение импульса равно ___.
2) Между двумя последовательными ударами о переднюю стенку молекула летит к задней стенке и возвращается, проходя полное расстояние ___ м.
3) За время t сек молекула, летящая со скоростью v м/сек, проходит расстояние ___ м.
4) Таким образом, в течение t сек молекула ___ раз возвратится назад и столько же рае ударится о переднюю стенку.
5) За время t сек молекула ___ раз ударится о переднюю стенку, передавал при каждом ударе импульс ___.
6) Таким образом, полное изменение импульса передней стенки из-за ударов одной молекулы за время t сек равно ___.
7) Но в сосуде находится N молекул, из которых ___ движутся взад и вперед. Полное изменение импульса передней стенки из-за ударов всех молекул в течение t сек равно ___.
8) Но F∙t = Δ(импульса), т. е. F = Δ(импульса)/t, а в нашем случае средняя сила, действующая на переднюю стенку сосуда на протяжении t сек, равна[126] ___.
9) Давление = (сила)/(площадь), а площадь передней стенки равна ___.
Таким образом, среднее давление на переднюю стенку равно ___.
10) Объем сосуда равен ___.
Таким образом, произведение (давление)-(объем) = ___.
Но m — масса одной молекулы, а их всего N, так что полная масса газа в сосуде, М кг = ___ кг.
Подставляя М в написанное выражение, находим:
(давление)∙(объем) = ___.
11) Если мы работаем с закрытым сосудом, исключающим утечку газа, то масса М постоянна.
Предположим, что температура также поддерживается постоянной. Тогда опыты показывают, что средняя скорость v будет оставаться постоянной. Если объем изменяется, то, согласно п. 10, ___.
12) Если мы измеряем объем газа, скажем в колбе, его массу (взвешивая колбу с газом и после его удаления) и с помощью барометра давление, то п. 10 дает возможность получить очень важную информацию — вычислить величину ___, которая представляет ___ молекул.
13) Единицы измерения. Если в п. 12 объем брался в м3, то массу нужно брать в ___, а давление должно измеряться в ___.
14) Из нашей теории получены два полезных предсказания: поведение газа п. 11 и заключение п. 12. Кроме того, получатся и другие результаты, но да все это нужно заплатить предположениями, которые легли в основу всего механизма. Выпишите на отдельном листе все предположения, сколько сможете,
а) относительно общих законов, применяемых к молекулам;
б) относительно предполагаемых свойств молекул, их поведения, размеров и т. д.
Трудности простейшей теории
Выражение, которое вы получили в задаче 2, по-видимому, приводит к непрерывному давлению молекул на стенку, предсказываемому законом Бойля. Но как может град ударов молекул создать непрерывное давление? Разве что они будут сыпаться c такой частотой, что сольются в постоянную силу. Для этого молекулы газа должны быть очень малы и многочисленны. Если они малы, то любая твердая преграда наподобие стенок сосуда будет казаться массивной по сравнению с отдельной молекулой. Тогда при соударении стенка сглаживает передаваемые ей импульсы в постоянное давление, которое мы и наблюдаем. (Что бы вы увидели, если бы стенки сосуда были столь же легкими, как сами молекулы?)
В приведенных задачах предполагалось, что молекулы летят от одной стенки к другой, не сталкиваясь по пути друг с другом, а ведь они, разумеется, сталкиваются, и без дальнейшей информации мы не сможем сказать, насколько часто. Как это повлияет на наши предсказания?
Фиг. 6. Сглаживание ударов.
Заштрихованная площадь — полная величина F∙Δt.
Задача 3. Столкновения в простейшей теорпи
а) Покажите, что для простых рассуждений в задачах 1 и 2 не имеет значения, сталкиваются молекулы или нет. (Рассмотрите две молекулы, которые движутся взад и вперед, от одной стенки к другой и при встрече проходят друг над другом без соударения. Затем предположите, что они сталкиваются лоб в лоб и отскакивают назад. Почему их вклад в давление не изменится? Объясните это с помощью чертежа.)
б) Какие специальные предположения о свойствах молекул требуются для ответа на поставленные выше вопросы?
в) Предположим, что молекулы, стали очень большими (сохранив, однако, свою скорость, массу и т. д.). Как это повлияет на давление вследствие их соударений? Возрастет ли оно, уменьшится или останется прежним?
г) Дайте ясное обоснование вашего ответа на предыдущий вопрос.
Молекулярный хаос
Молекулы сталкиваются друг с другом и со стенками совершенно случайным образом (лоб в лоб, под углом, вскользь) и поэтому не могут сохранять постоянную скорость v. Одни набирают скорость при соударениях, другие же теряют ее. Газ представляет собой хаос случайно движущихся молекул, скорости которых (при каждом соударении) могут изменяться в широких пределах. Но все же должно соблюдаться некое постоянство — ведь газ оказывает постоянное давление.
Выражение p∙V = 1/3 (N∙m∙v¯2) вовсе не подразумевает, что все N молекул движутся с одной и той же скоростью и каждая дает вклад mv¯2. Мы говорим, что молекула 1 движется со скоростью v1, молекула 2 — со скоростью v1 и т. д, а молекула N — со скоростью vN. Тогда[127]
p∙V = 1/3 (mv12 + mv22 +… + mvN2) =
= 1/3 [m∙(v12 + v22 +… + vN2)] = 1/3 m∙(N∙Среднее v2)
Следовательно, v2 в нашем выражении должно быть средним v¯2. Именно поэтому мы ставим над ней черточку, обозначающую среднее значение. Так что теоретическая формула приобретает вид
ДАВЛЕНИЕ∙ОБЪЕМ = 1/3 m∙(N∙v¯2)
Мы знаем, что если поместить газ в сосуд, то его давление с течением времени не будет прыгать вверх и вниз; давление и объем остаются постоянными. Следовательно, несмотря на все происходящие при столкновениях изменения, средняя скорость молекул v¯2 остается постоянной. Таким образом, теория уже помогла нам навести порядок в молекулярном хаосе — получить постоянную v¯2.
Более элегантный вывод
Введение множителя 1/3 для большинства выглядит как искусственный трюк. Вот более элегантный метод, в котором скорости молекул складываются с помощью простейших правил статистики. Предположим, что молекула 1 движется в сосуде со скоростью v1 под углом к стенке (фиг. 7).
Фиг. 7. Другое рассмотрение движения молекул газа.
Каждая скорость v разложена на три составляющие xv, yv и zv, параллельные граням сосуда. Затем по xv2 вычисляется давление и мы приходим к тому же результату.
Разложим вектор v1 на три компоненты по осям х, у и z, параллельным стенкам. Тогда v1 будет результирующей компонент скоростей xv1 вдоль оси х, yv1 вдоль оси у, a zv1, вдоль оси z. Поскольку оси взаимно перпендикулярны, то по теореме Пифагора
v12 = xv12 + yv12 + zv12
для молекулы 2
v22 = xv22 + yv22 + zv22
для молекулы 3
v32 = xv32 + yv32 + zv32
…
и т. д.
vN2 = xvN2 + yvN2 + zvN2
Сложим все эти равенства:
(v12 + v22 + v32 +… + vN2) =
= (xv12 + xv22 + xv32 +… + xvN2) +
+ (yv12 + yv22 + yv32 +… + yvN2) +
+ (zv12 + zv22 + zv32 +… + zvN2)
Фиг. 8. Составляющие скорости.
По теореме Пифагора v12 = xv12 + yv12 + zv12
Разделив на число молекул N, получим среднее значение:
v¯2 = xv¯2 + yv¯2 + zv¯2
Призовем теперь на помощь соображения симметрии и потребуем (игнорируя малые отклонения за счет гравитации), чтобы все три средних в правой части уравнения были равными; случайное движение большого числа молекул должно давать одно и то же распределение скоростей в любом направлении:
xv¯2 = yv¯2 = zv¯2
т. е.
v¯2 = 3∙zv¯2
Чтобы получить давление на стенку сосуда, мы будем дальше рассуждать по аналогии с задачей 2, используя xv — составляющую скорости молекул вдоль сосуда. (Именно эта составляющая скорости и нужна нам, ибо yv и zv влияют только на движение от одной боковой стенки к другой и не участвуют в передаче импульса нашим стенкам.) Поэтому вклад молекулы 1 в произведение (давление)∙(объем) будет m∙xv1¯2, а вклад всех N молекул будет
m∙(xv12 + xv22 + … + xvN2), или m∙N∙xv¯2
Но он равен m∙N∙(v¯2/3), так что
ДАВЛЕНИЕ∙ОБЪЕМ = 1/3 N∙m∙v¯2
Предсказания кинетической теории газов
Рассмотрение молекулярных столкновений и законы Ньютона привели нас к выводу, что
ДАВЛЕНИЕ∙ОБЪЕМ = 1/3 N∙m∙v¯2
Он напоминает закон Бойля. Множитель 1/3 постоянен; N — число молекул — тоже постоянно (если они не улетают и не распадаются); m — масса молекул — постоянна. Поэтому если средняя скорость остается постоянной, то постоянно и 1/3 N∙m∙v¯2, а следовательно, постоянно и p∙V, как обнаружил Бойль. Но остается ли неизменной скорость молекул? Сейчас мы не можем гарантировать это.
Но давайте на минуту забежим вперед и предположим, что молекулярное движение связано с тепловым состоянием газа и что при постоянной температуре средняя скорость молекул газа постоянна, как бы мы его ни сжимали[128]. Объяснение этого факта вы получите позднее, а сейчас примите его на веру. Сделав это, найдем:
Для газа при постоянной температуре произведение p∙V постоянно.
Более простая форма получится, если вместо объема изменять плотность: удвойте число молекул в том же сосуде, и давление удвоится.
Что это, удивительное объяснение закона Бойля? Едва ли удивительное. Мы вкладывали в него столько предположений, не упуская из виду желаемый результат, что он вряд ли может польстить нашему тщеславию. Теория, вобравшая столько предположений и предсказавшая один-единственный уже известный закон, и то при дополнительном допущении относительно постоянства температуры, вряд ли заслуживает внимания. Но наша теория — это только начало. Кроме того, она позволяет «объяснить» испарение, диффузию, внутреннее трение в газах. Она предсказывает, как ведет себя газ при сжатии, облегчает конструирование вакуумных насосов. Она приводит также к измерениям, подтверждающим законность наших предположений. Однако, прежде чем перейти к дальнейшему развитию теории, остановимся на вопросе: «на самом ли деле существуют такие штуки, как молекулы?»
Существуют ли молекулы?
«Самое страшное — это косвенные улики. Обвинитель имеет в своем распоряжении все средства для расследования. Он вскрывает факты и отбирает только те, которые, по его мнению, существенны. Но если он придет к заключению о виновности подсудимого, то для него существенными фактами будут лишь те, которые указывают на вину подсудимого. Вот почему косвенные улики — ложь. Сами по себе факты не имеют никакого смысла. Объяснение фактов — вот единственное, что принимается в расчет».
Эрл Станли Гарднер
«Дело о попугае — лжесвидетеле»
Сто лет назад молекулы казались полезным понятием. Это была плодотворная концепция, позволившая легко обнаружить закономерности у химических соединений и давшая толчок развитию простейшей теории газов. Но существуют ли молекулы на самом деле?
В те времена имелись лишь косвенные улики, которые делали эту гипотезу вероятной. Однако многие ученые были настроены скептически, а один великий химик вплоть до начала этого века даже настаивал на своем праве не верить в молекулы и атомы, хотя прямне экспериментальные доказательства появились довольно давно, примерно в 1827 г. Это было броуновское движение.
Броуновское движение
Шотландский ботаник Роберт Броун (1773–1858) сделал удивительное открытие — он увидел молекулярное движение. Рассматривая через микроскоп взвешенные в воде твердые частицы, он обнаружил, что они находятся в беспрестанном движении. Этот танец делал частицы похожими на живые существа, которые ни на минуту не прекращали своего движения. При нагревании танец убыстрялся, а после охлаждения замедлялся до первоначального темпа. Теперь мы знаем, что любые твердые частицы в жидкости будут участвовать в точно таком же беспорядочном танце, лишенном ритма и системы. Броун наблюдал результат столкновений молекул воды с твердыми частицами. Их толкали со всех сторон, как толкали бы слона, окажись он на футбольном поле во время матча.
Понаблюдайте сами за «броуновским движением». Посмотрите через сильный микроскоп на частицы сажи в воде. А еще проще, понаблюдайте в небольшой микроскоп за дымом. Наполните черный ящик дымом от сигареты или гаснущей спички и осветите его сбоку сильным светом. Дым рассеивает во всех направлениях голубовато-белый свет, часть которого попадает и в микроскоп. Под микроскопом дым представляется маленькими кусочками белого пепла, которые скачут туда и сюда в совершенно беспорядочном танце[129] (см., например, фиг. 89, стр. 530).
Понаблюдав за частицами пепла, вы поймете, почему Броун сначала принял их за живые существа, но вы можете представить себе, что это движение возникает в результате хаотических ударов молекул воздуха. Сегодня мы не просто считаем, что так может быть, а уверены, что это именно так и есть, ибо способны вычислить действие этих ударов и проверить наши вычисления с помощью наблюдений. Если бы молекул воздуха было очень много и они были бы бесконечно малы, они бомбардировали бы большую частицу пепла симметрично со всех сторон и мы не смогли бы увидеть броуновского движения. Но, с другой стороны, если бы окружающий воздух состоял из небольшого числа больших молекул, то частицы пепла при ударе молекул совершали бы неожиданные дикие скачки. Ясно, что истина лежит где-то посредине: в сосуде имеется множество молекул, ударяющих частицу пепла со всех сторон много раз в секунду. За короткий промежуток времени в нее попадали с каждой стороны сотни молекул, но на одну сторону случайно приходится на несколько сот толчков больше, чей на другую, и частица заметно перемещается. Большие скачки редки, но несколько мелких перемещений в одном и том же направлении превращаются в наблюдаемый сдвиг. Детальные наблюдения и расчеты говорят о том, что под микроскопом мы наблюдаем именно эти результирующие сдвиги. Хотя отдельные перемещения слишком незначительны и мы их не можем разглядеть, все же можно оценить их скорость, записывая и анализируя большие отклонения.
Вы сами увидите, что частицы поменьше танцуют быстрее. А теперь мысленно вообразите, что частицы становятся все меньше и меньше. Какое движение вы увидите, если размеры частиц достигают размеров молекул при условии, конечно, что мы сможем разглядеть саму молекулу? Но можем ли мы увидеть молекулы?
Можно ли увидеть молекулы?
Действительно, можно ли' А это было бы очень полезно. Мы уверены, что то, что мы видим, существует на самом деле, хотя имеется множество оптических иллюзий. Все исследования молекул, проведенные на протяжении прошлого века, привели ученых к заключению, что увидеть молекулы — дело безнадежное. Не просто маловероятно, а именно невозможно, и по веским физическим причинам. Мы реагируем на свет, который представляет собой волны с очень малой длиной волны — всего лишь несколько тысяч ангстрем от гребня до гребня[130]. Эти волны и создают видимое изображение Невооруженным глазом мы различаем форму булавочной головки с поперечником в 1 мм, или 1 0 000 000 А°;
— с помощью увеличительного стекла можем разглядеть волос толщиной 1 000 000 А°,
— с помощью слабого микроскопа видим частицы дыма размером 100 000 А°;
— с помощью сильного микроскопа видим бактерии размером от 10 000 до 1000 А°.
Но на этом ряд обрывается. Он должен оборваться — его ограничивает длина волны видимого света. Волны могут сделать видимыми препятствия, которые по своим размерам больше или порядка их длины. Например, океанские волны оставляют за островом ясно видимую тень спокойной воды. На меньшие препятствия они реагируют совсем по-другому. Встречая небольшое деревянное бревно, океанские волны не образуют за ним никакой тени. Они просто обтекают бревно и смыкаются за ним, как будто его и нет совсем. Слепой, бредущий по берегу штормового моря, может почувствовать присутствие близлежащего острова, но никогда не узнает о маленьком бревне, которое находится где-то тут же возле него[131].
Длины световых волн лежат в пределах от 7000 А° для красного света до 4000 А° — для фиолетового. Попытка проникнуть в область коротковолнового ультрафиолета путем применения фотопленки (вместо глаза), натолкнулась на препятствие — волны поглощались, еще будучи длиннее 1000 А°; линзы, образцы и даже сам воздух «непрозрачны» для такого ультрафиолета. Рентгеновские лучи с еще более короткими длинами волн способны проходить через вещество и создавать тени, но практически не фокусируются линзами. Хотя рентгеновские лучи и имеют малые длины волн и могли бы помочь проникнуть в более тонкие детали структуры, они дают лишь теневую картину. Таким образом, барьер, созданный волновой природой света, кажется непреодолимым. Мы можем увидеть бактерии размером до 1000 А°, а вот вирусам, имеющим в десять раз меньшие размеры, суждено остаться невидимыми. Увидеть же молекулы, которые меньше вирусов в десятки раз, совсем безнадежно. А между тем вирусы, вызывающие многие болезни, привлекают пристальное внимание медиков. Существует мнение, что вирусы находятся на границе между живыми организмами и химическими молекулами. Увидев молекулы, мы смогли бы ответить на многие важнейшие вопросы химии.
Невидимость молекул доставляла много неудобств, но казалась неизбежной. В начале этого века косвенную информацию о строении молекул удалось получить с помощью рентгеновских лучей. Упорядоченные структуры атомов и молекул в кристаллах могут рассеивать рентгеновские лучи регулярным образом, наподобие того, как «расщепляется» свет, проходящий через сотканный материал (посмотрите ночью на удаленный фонарь через тонкий носовой платок или зонтик).
Картины рассеяния рентгеновских лучей выявляют расположение атомов и расстояние между слоями в кристаллах. Они подтвердили оценку размеров молекул из измерений с помощью тонких пленок масла. В последнее время дифракционные картины позволили установить очертания некоторых больших молекул, т. е. не только установить детали кристаллической структуры, но и получить указания о форме молекул. Затем, пока некоторые физики сокрушались, что «нет надежды», был изобретен электронный микроскоп. В нем вместо света через исследуемый тонкий образец проходит пучок электронов, который затем фокусируется электрическими и магнитными полями, образуя на фотопленке сильно увеличенное изображение. Длины электронных воля настолько меньше световых[132], что позволяют различать даже «молекулы».
Поэтому теперь мы можем «рассматривать» вирусы с огромным увеличением и даже удается сфотографировать большие молекулы. Полученные контуры молекул хорошо согласуются с теми умозрительными картинами, которые рисовали химики, исходя из хитроумных рассуждений о химических свойствах этих молекул.
В последнее время созданы еще более «тонкие» методы. В конце нашей книги мы приводим фотографию отдельных атомов металла на острие булавочной головки. Почему мы не показываем ее сейчас? Да потому, что прежде необходимо познакомиться с атомной физикой, ее методами и подходами. Тогда вы поймете, насколько правильна эта фотография. Мы будем говорить об электронах сверхвысоких энергий, которыми сейчас прощупывают структуру атомных ядер, исследуя их теневое изображение.
За последнее 100 лет молекулы из мельчайших гипотетических кирпичиков теории превратились в такую реальность, что мы пытаемся даже разглядеть их форму. Большинство характеристик молекул — скорость, их число, масса, размер — были получены еще в прошлом веке на основе кинетической теории газов Теория порождала измерения, и измерения подтверждали теорию. А теперь мы оставим заботу о том, как увидеть молекулы, и посмотрим, что можно получить из простых экспериментов.
Измерение скорости молекул
Вернемся к нашему результату:
ДАВЛЕНИЕ∙ОБЪЕМ = 1/3 N∙m∙v¯2
Если верить этому выражению, то можно оценить реальную скорость молекул. Ведь N — это число молекул, а m — масса одной молекулы, так что Nm — общая, масса молекул газа в сосуде. Следовательно, выражение переписывается в виде
ДАВЛЕНИЕ∙ОБЪЕМ = 1/3 M∙v¯2
где М — общая масса молекул газа. Мы можем взвесить образец газа, измерить его объем при известном давлении, подставить результаты наших измерений в написанное выше соотношение и найти величину v¯2 — среднее значение квадрата скорости.
Опыт 1. Необходимые измерения показаны на фиг. 9. Мы измеряем давление обычного комнатного воздуха ртутным барометром. (Высота столбика, плотность ртути и величина ускорения силы тяжести, g = 9,8 ньютон/кг, дадут давление в абсолютных единицах, ньютон/м2[133].)
Фиг. 9. Косвенное измерение скорости молекул на основе кинетической теории газов.
Взвесим воздух, который заполняет колбу. Для этого взвесим колбу, заполненную воздухом при атмосферном давлении, а затем, после того как весь или почти весь воздух выкачан из колбы, погрузим колбу в воду, откроем пробку, чтобы вода заместила воздух. Измерение объема воды в колбе даст нам объем воздуха известной массы. Подставив эта результаты, вычислим v¯2, а следовательно, и квадратный корень из него √v¯2, который можно назвать средней скоростью (точнее, средней квадратичной скоростью).
В задаче 4 приведены результаты этих измерений. Вычислите скорость.
Задача 4. Скорость молекул кислорода
Опыт показывает, что 32 кг кислорода при атмосферном давлении и комнатной температуре занимают объем 24 м3.
а) Вычислите плотность кислорода, т е. (масса)/(объем).
б) Используя соотношение кинетической теории газов, вычислите средний квадрат скорости молекул v¯2.
в) Извлеките корень и найдите среднюю квадратичную скорость в м/сек.
Молекулы воздуха носятся со скоростью 400 м/сек! Итак, теория дает полезные предсказания и подтверждает свои предположения, как ей и пристало! Мы предположили, что газ состоит из молекул, которые, по-видимому, движутся быстро, и наша теория на основе простых измерений показывает, сколь быстро они движутся. Но теория не может доказать правильность собственных предсказаний. Результат может подтверждать лишь правильность предположений теории. Так что нужна экспериментальная проверка. Если теория пройдет одно или два испытания, мы вполне можем положиться на ее дальнейшие предсказания.
Скорость молекул; экспериментальные данные
Грубые указания о величине скорости мы можем получить, изучая скорость звука и броуновское движение.
Задача 5. Скорость звука
Мы считаем, что звук переносится волнами сжатия и разрежения, причем изменение плотности и движение передаются от одной молекулы к другой благодаря соударениям. Если воздух действительно состоит из движущихся молекул, то что вы можете сказать об их скорости, зная, что измерения скорости звука в воздухе дают величину 340 м/сек?
Задача 6. Броуновское движение
Поглядев в микроскоп на дым, вы увидите быструю пляску больших частиц пепла и бешеную — маленьких.
а) Частицы могут быть настолько малы, что их не видно. Каково их движение?
б) Считая молекулы еще меньшими частицами пепла, что можно сказать об их движении?
Обе задачи просто имеют общее решение. А вот опыт, который показывает, насколько быстро движутся молекулы газа.
Опыт 2. На дно тонкой стеклянной пробирки выпускается жидкий бром[134]. Жидкость немедленно испаряется, и бурый пар, или «газ», медленно расползается по трубке. Затем тот же эксперимент повторяется с пробиркой, из которой выкачан воздух. Теперь освобожденные пары брома движутся очень быстро. (Молекулы брома движутся столь же быстро и в воздухе, но распространение газа замедляется множеством столкновений с молекулами воздуха.)
Фиг. 10. Движение молекул брома.
а — диффузия брома в воздухе; б — бром, выпущенный в вакуум; в — капсула
Прямые измерения
Настоящей проверкой должны служить прямые измерения. Скорость молекул измерялась несколькими экспериментаторами. Мы рассмотрим типичный эксперимент, проделанный Цартманом.
Фиг. 11. Прямое измерение скоростей молекул.
а — схема опыта Цартмана; б — различные стадии вращения барабана; в — развернутый образец пленки
1 — метки от молекул различных скоростей, 2 — нулевая метка, сделанная молекулами при неподвижном барабане.
Опыт 3. Пучок молекул пропускался через прорезь в цилиндрическом барабане, который мог быстро вращаться. Это были молекулы висмута, которые испарялись в вакууме из жидкого расплава в маленькой печи. Затем серия экранов с прорезями выделяла узкий пучок, который попадал в барабан. При каждом повороте щель барабана пропускала только небольшую порцию движущихся молекул. Когда барабан покоился, молекулы пролетали к противоположной стенке барабана и создавали отметку на пленке, расположенной за щелью. При вращении барабана пленка за время пролета молекул через барабан перемещалась на заметное расстояние и метка сдвигалась в новое положение. По этому сдвигу метки, диаметру барабана и скорости его вращения вычислялась скорость молекул. Когда пленка была извлечена из барабана, то на ней оказалась резкая центральная метка из осевшего металла, а метка, возникшая при вращении, имела вид размазанного пятна, которое говорило, что скорости молекул не были одинаковыми, а были разбросаны в довольно широкой области. Молекулы газа движутся хаотически, испытывая столкновения, и следует ожидать, что в любой момент имеется довольно разнообразный набор скоростей. В предсказаниях же кинетической теории фигурирует средняя, точнее, средняя квадратичная скорость √(v¯2). Распределение скоростей относительно средней можно предсказать о помощью математической статистики случайных событий.
В опыте Цартмана пучок горячих молекул пара будет обладать тем же распределением скоростей с пиком при величине, характеризуемой температурой. Измерения потемнения пленки дали в точности такое же распределение и среднюю величину, очень хорошо согласующуюся с предсказанной простейшей теорией (фиг. 12)[135].
Фиг. 12. Результаты опыта Цартмана.
Кривая характеризует плотность почернения (экспериментальные результаты). Крестиками показаны значения, предсказываемые кинетической теорией газов на основе статистики.
Скорости молекул в других случаях. Диффузия
Взвешивание бутылки водорода или гелия при атмосферном давлении и комнатной температуре показывает, что эти газы менее плотны, чем воздух; углекислый газ более плотен. Поэтому, согласно нашему предсказанию, p∙V = 1/3M∙v¯2, молекулы водорода и гелия движутся быстрее молекул воздуха (при той же температуре), а молекулы углекислого газа — медленнее. Вот что получается на самом деле.
Задача 7. Скорости
а) Если молекулы кислорода при комнатной температуре движутся со скоростью около 400 м/сек, то с какой скоростью движутся молекулы, водорода?
б) Какова средняя скорость молекул гелия по сравнению с молекулами водорода при той же температуре? (Найдите отношение «средних» скоростей.)
в) Какова скорость молекул углекислого газа по сравнению с молекулами воздуха при той же температуре? (Найдите отношение «средних» скоростей.)
Задача 8
Рискните угадать[136], будет ли скорость звука в гелии той же, что и в воздухе. А может быть больше или меньше?
Проверьте вашу догадку, наполнив органную трубу сначала воздухом, а затем гелием (или углекислым газом), или же вдохните гелий, а затем попробуйте сказать что-нибудь. (Рот и нос работают как миниатюрная органная труба.) Изменение скорости звука изменяет время, необходимое для прохождения звука от одной стенки трубы до другой, и изменяет таким образом частоту колебаний звука, повышая частоту основного тона.
Задача 9
Как, по вашему мнению, изменится скорость звука в воздухе при изменении давления и постоянной температуре? (Ответьте на этот вопрос, учтя, что 28,8 кг воздуха при комнатной температуре и давлении 1 атм занимают 24 м3, а при давлении 2 атм — 12 м3.)
Диффузия
Если скорости молекул разных газов столь отличны, то при прохождении через длинную тонкую трубку один газ должен отделяться от другого. Для этого трубочки должны быть настолько длинными и узкими, чтобы молекулы газа просачивались через них поодиночке.
Опыт 4. Подходящими порами обладает, например, неглазурованная керамика (фиг. 13 и 14). Именно такими порами пронизана белая керамическая кружка J. Если наполнить ее сжатым газом и закрыть пробкой S, то, как и следовало ожидать, газ через поры постепенно вытечет из кружки в атмосферу. Но если внутри и снаружи давление одинаково (атмосферное), то трудно ожидать утечки, даже если внутри и снаружи были разные газы. Однако изменения происходят, указывая на разные скорости молекул. Описанный опыт начинается с того, что внутри кружки находится воздух, а вне ее — другой газ, также при атмосферном давлении. Молекулы водорода проникают в кружку быстрое, чем оттуда выходит воздух, или же воздух выходит быстрее, чем «вползают» молекулы СО2. Это качественная демонстрация диффузии, но она подсказывает способ разделения смеси газов. Поместите внутрь кружки смесь водорода и СО2. Тогда водород независимо от того, что находится вне кружки — воздух или вакуум, будет диффундировать быстрее, чем СО2, так что, повторяя этот процесс несколько раз, можно получить почти чистый водород.
Фиг. 13. Диффузия газов.
Водород диффундирует внутрь сосуда сквозь пористую стенку J быстрее, чем воздух из него
Фиг. 14. Диффузия газов.
Углекислый газ диффундирует внутрь сосуда через пористую стенку J медленнее, чем воздух из него
В этом и состоит физический метод разделения, основанный на различии молекулярных скоростей, которое обусловлено различием масс молекул (фиг. 15). Здесь не требуется различия химических свойств, и им можно пользоваться для разделения «изотопов» — близнецов, которые совершенно идентичны химически, но немного отличаются атомным весом. Когда впервые были открыты изотопы — один образец газообразного неона оказался на 10 % плотнее другого, а одни атомы свинца тяжелее других, — это казалось любопытным курьезом. Разделение имело смысл с точки зрения демонстрации эффекта. Диффузия естественной смеси неона в атмосфере давала такую возможность. Ню после того как стало известно, что в природном уране перемешаны два изотопа, один из которых легко расщепляется, а другой нет, выделение редкого изотопа стало вопросом первостепенной важности. Сейчас для этого в огромных масштабах используют диффузию газов (см. задачу 11 и фиг.16–18; см. также гл. 30 и 43[137].
Фиг. 15. Диффузия газов.
Воздух и углекислый газ при атмосферном давлении разделяются пористой перегородкой. Сначала они занимали равные объемы при одинаковом давлении и содержали одинаковое число молекул (а). Но молекулы воздуха в среднем проходят по порам быстрее, чем молекулы СО2. Поэтому число молекул и давление становятся неодинаковыми (б).
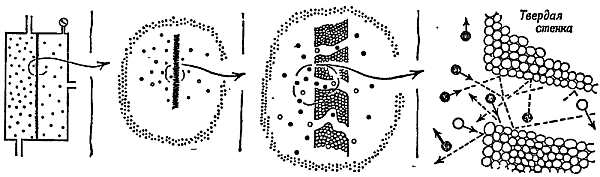
Фиг. 16. Разделение изотопов урана с помощью диффузии UF6 через пористую перегородку.
Молекулы газа, много раз соударяясь, с перегородкой и стенками пор, частично проникают сквозь них.
Фиг. 17. Разделение изотопов урана с помощью диффузии UF6 через пористую перегородку (а) и многоступенчатое разделение диффузией (б).
Смесь, прошедшая первую ступень, перекачивается на вход второй ступени. Неиспользованная смесь перекачивается назад на вход предыдущей ступени
Фиг. 18. Разделение изотопов урана с помощью диффузии.
Чтобы добиться почти полного отделения U235F6, необходимы тысячи ступеней
Температура
Нагревание газа увеличивает р или V. С увеличением температуры всегда возрастает pV, а поэтому и 1/3 Nmv¯2. Следовательно, нагревание газа увеличивает v2 и заставляет молекулы двигаться быстрее. В этом суть эффекта повышения температуры.
Задача 10
а) Как по-вашему, при повышении температуря воздуха скорость звука станет больше, меньше или останется той же самой? Объясните.
б) Как вы думаете, при повышении температуры диффузия газов происходит быстрее, медленнее или с той же скоростью? Объясните.
Развитие кинетической теории газов
Мы не в силах дать точных ответов на подобные вопросы, пока не изучим подробнее теплоту, температуру и энергию. Затем мы сможем извлечь новые данные о внутреннем трении в газе, теплопроводности и найдем способ измерения массы отдельной молекулы, так что сможем сосчитать мириады молекул в объеме газа. Мы вернемся к кинетической теории газов после изучения энергии. И именно кинетическая теория газов приводит нас к понятию энергии.
Что такое mv2?
Выражение 1/3 Nmv2 очень важно с точки зрения изучения газов. Оно означает (забудем на время множитель 1/3):
ЧИСЛО МОЛЕКУЛ ГАЗА∙(mv2 одной молекулы).
Что же такое mv2 для движущейся молекулы? Конечно, это масса, умноженная на квадрат скорости, но какого рода величину она характеризует? Каковы ее свойства? Уж не является ли она одним из членов ряда m… mv… mv2…? Масса m нам знакома. Она считается постоянной, а ее полное значение — сохраняющейся величиной. Знаком нам и mv — импульс. Он рассматривался как вектор, который также сохраняется. В такой ли степени полезна величина mv2? Строение ее таково:
mv∙v = Ft∙v,
или
СИЛА ВРЕМЯ ∙ РАССТОЯНИЕ / ВРЕМЯ
так что mv2 имеет вид (сила)∙(расстояние). Полезно ли это произведение? Чтобы сила действовала на некотором расстоянии, необходим двигатель, потребляющий топливо. Топливо… энергия.
Мы увидим, что для появившегося в теории газов выражения mv2 необходим только множитель 1/2, чтобы превратить его в «энергию».
Задача 11. Разделение урана (вариант см. гл. 30, задача 3)
Молекула кислорода содержит два атома, и мы обозначаем ее O2; молекула водорода также состоит из двух атомов Н2, а газообразный фторид урана имеет формулу UF6.
Химические опыты показывают, что относительные массы атомов О, Н, F и U равны 16, 1, 19, 238. Доказательства и блестящая догадка Авозадро приводят к заключению, что стандартный объем любого газа при 1 атм и комнатной температуре содержит одно и то же число молекул независимо от сорта газа (одно и то же для О2, Н2 и UF6). Кинетическая теория газов подтверждает эту догадку (см. гл. 30).
а) Обратившись вновь к задаче 7, вы увидите, что замена О2 на Н2 меняет массу молекулы в отношении 32:2. Каково изменение при той же температуре у v¯2, т. е. у средней квадратичной скорости? (Во сколько раз молекула водорода при комнатной температуре движутся быстрее молекул кислорода? Напишите соотношение между новой скоростью и старой. Здесь вам не нужно повторять всю арифметику; просто проследите за изменяющимся множителем)
б) Проделайте то же самое, заменив кислород газообразным фторидом урана. Сделайте грубый арифметический расчет и найдите приближенное числовое значение.
в) Существует несколько сортов атомов урана. Масса обычного урана равна 238 (по сравнению с 16 для кислорода), но редкий изотоп 0,7 % в смеси, полученной из руды), тот самый, который легко делится, имеет массу 235. Один из способов (очень медленных) отделения этого редкого изотопа урана от обычного состоит в превращении смеси во фторид и диффузии газообразного фторида через пористую стенку. Поскольку молекулы фторида U235 имеют несколько иную скорость, то после диффузии получится смесь с иными пропорциями.
1) Обогащается ли она или обедняется U235?
2) Обоснуйте ваш ответ на предыдущий вопрос.
3) Оцените разницу в % средних скоростей молекул [U235F6] и [U238F6].
(Примечание. Как уже обсуждалось в гл. 11 (т. 1), изменение на х% в некоторой величине Q приводит к изменению 1/2 х% для величины √Q.)
Задача 12
На фиг. 13 и 14 показаны два примера диффузии. Опишите, что там происходит, и объясните эксперимент.
Задача 13. Сжатие газа с молекулярной точки зрения
а) Когда упругий шарик испытывает лобовое соударение с массивной стенкой, он отражается с первоначальной скоростью. То же происходит и с мячом, ударяющимся о массивную биту, которая удерживается на месте. Однако если бита движется в направлении к мячу, то он отлетит с другой скоростью. Как он будет двигаться — быстрее или медленнее?
б) (Вопрос трудный. Нужно хорошо подумать.) Что произойдет со временем упругого соударения, когда бита движется по направлению к мячу? Будет ли оно длиннее, короче или тем же самым, что и в случае неподвижной биты?
в) Если газ в цилиндре сжимается поршнем, его температура возрастает. Как это явление объясняется с точки зрения кинетической теорий газов?
г) Предположим, что сжатый газ расширяется и толкает поршень. Что произойдет с газом?
Задача 14. Размер молекул и их пробег
Пусть закрытый сосуд содержит большое число молекул газа при фиксированной температуре. Предположим, что по приказу волшебника молекула раздулись и стали больше, хотя их число, скорости и объем cocyда не изменились.
а) Как это повлияет на среднее расстояние от центра до центре молекул (сильно увеличится, уменьшится или изменится немного)?
б) Объясните ваш ответ.
в) Как это повлияет на среднее расстояние, проходимое молекулами между двумя соударениями (средняя длина свободного пробега)?
г) Объясните ваш ответ.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК