Атомные спектры и электронные слои
Атомные спектры и электронные слои
Физики собрали в спектроскопических лабораториях все известные элементы. Они бомбардировали атомы различных элементов быстрыми электронами, отщепляли от атомов то один, то два, то несколько электронов, действовали на атомы сильными магнитными и электрическими полями, словом, ставили атомы во всевозможные условия. И все время наблюдали, какие при этом получаются спектры, как эти спектры изменяются под влиянием различных условий. А из этого делали выводы о том, какие же перестройки происходят внутри атомов.
Рассмотрим один из примеров, показывающий, как по атомным спектрам физики определяют строение атомов.
Возьмем элемент литий. Он стоит в таблице Менделеева на третьем месте, у его атомов по три электрона. Если атом не возбужден, электроны обращаются вокруг ядра по устойчивым орбитам. Все эти орбиты можно занумеровать одним номером — № 1; но мы должны помнить, что это номера орбит для разных электронов. Не можем ли мы по спектрам атомов лития узнать что-либо еще о его орбитах?
Будем обстреливать атомы лития из электронной пушки. Мы уже знаем, что при малой энергии электронов-снарядов атомы лития не будут возбуждаться. Первое возбуждение наступит тогда, когда электроны-снаряды достигнут энергии в 1,86 электрон-вольта. При захвате этой энергии наружный электрон лития перейдет на орбиту № 2. Другие электроны останутся на своих прежних орбитах: они ближе к ядру, сильнее с ним связаны. Их такой малой энергией не возбудить. Мы узнаем о возбуждении наружного электрона благодаря тому, что литий будет испускать излучение с частотой 4,6·1014 циклов; эта частота будет свидетельствовать об обратном перескоке наружного электрона с орбиты № 2 на орбиту № 1. При захвате следующих порций энергии наружный электрон будет переходить на новые орбиты, а при обратном перескоке испускать излучение с новыми частотами.
Чем больше порция захваченной атомом энергии, тем дальше будет орбита наружного электрона, тем слабее будет его связь с ядром. При захвате энергии в 5,4 электрон-вольта наружный электрон вылетает из атома совсем— атом становится ионом (однократная ионизация). Если однократно ионизованный ион лития захватит извне медленно движущийся электрон, он испустит излучение с частотой 12,96·1014 циклов.
Заметим, что частоты, с которыми мы имеем дело при возбуждении наружного электрона, лежат в пределах от 4,6·1014 до 12,96·1014 циклов. Последняя частота больше первой всего в 2,9 раза.
При обстреле лития электронами, имеющими энергию не ниже 75 электрон-вольт, появится излучение с частотой 182,0·1014 циклов. Атомы лития, испускающие это излучение, дважды ионизованы. Второй электрон вылетает из атома при захвате энергии в 75 электрон-вольт. А излучение с указанной частотой испускается, когда дважды ионизованный атом лития захватит извне медленно движущийся электрон. Последний, третий, электрон вылетает из атома при захвате энергии в 121 электрон-вольт, что соответствует излучению с частотой 294,7·1014 циклов.
Мы получили ряд энергий ионизации лития: энергия первой ионизации равна 5,4 электрон-вольта, второй — 75 электрон-вольтам, третьей — 121 электрон-вольту. Соответствующие этим энергиям частоты: 12,96·1014, 182,0·1014 и 294,7·1014 циклов. Эти энергии, или частоты, показывают, как крепко связаны электроны лития с ядром, сколь близко они находятся к ядру.
Сразу видно, что энергия связи второго электрона больше энергии связи наружного, наиболее слабо связанного электрона, в 14 раз. А вот энергия связи третьего, внутреннего электрона больше энергии второго всего в полтора с небольшим раза. Связь у двух внутренних электронов с ядром почти одинакова, их орбиты находятся недалеко друг от друга. Эти два электрона составляют тесную группу, или, как говорят физики, составляют один слой электронов. Наружный же электрон у лития обращается вокруг ядра вдалеке от внутреннего слоя электронов (рис. 36).
Так, изучая частоты излучений, ученые делают выводы о внутреннем строении атомов, о том, что электроны в атомах располагаются по слоям. В тяжелых атомах число таких слоев достигает семи. Физики называют их: слой К (ка), слой L (эль), слой М (эм) и т. д. Эти слои, кроме того, разделяются еще на подгруппы.
Частота рентгеновских излучений находится в пределах от 3·1016 до 3·1019 циклов; частота видимого света — в пределах от 0,8·1014 до 0,4·1014 циклов. Следовательно, частота рентгеновских излучений больше частоты видимого света в десятки тысяч раз. Во столько же раз больше и энергия фотонов рентгеновских излучений.
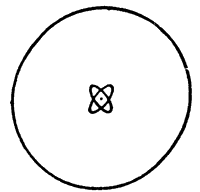
Рис 36. Модель атома лития. Два ближайших к ядру электрона составляют внутренний слой
Из этого следует, что высокочастотные рентгеновские спектры испускаются три перескоках электронов, которые движутся глубоко внутри атомов и сильнее всего связаны с ядром. Инфракрасные, видимые и ультрафиолетовые спектры (их называют оптическими) образуются в результате перескоков внешних электронов, связанных с ядром слабее.
Таким образом, исследования спектров помогли более ясно представить строение атомов.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
1. Спектры и спектральные линии
1. Спектры и спектральные линии Невозможно непосредственно изучать внутреннее строение атома, этого микромира невообразимо малых размеров, характеризуемого процессами, недоступными нашему прямому восприятию. Структура атома проявляется только косвенно в явлениях
Оптические спектры
Оптические спектры Мы уже знаем, что все вещество состоит из частиц, число разновидностей которых невелико. Электроны были теми элементарными частицами вещества, которые были открыты первыми. Но электроны являются также и элементарными квантами отрицательного
Спектры из темных линий
Спектры из темных линий После изобретения спектроскопа ученые пытались воспроизвести темные линии в лаборатории. Сначала надо было получить сплошной спектр всех цветов радуги. Это сделать просто. Как мы знаем, такой спектр дают раскаленные добела металлы. Потом надо
Дифракционные спектры
Дифракционные спектры Мы рассмотрели дифракционную картину одноцветных лучей. А какова будет картина, если мы дополнительно осветим решетку вторым, тоже одноцветным светом, но другой волны?Для вторых лучей направления освещенности будут уже не ?1, ?2, ?3 и т. д., а какие-то
Молекулярные спектры
Молекулярные спектры Особенно большое значение для химии имело изучение спектров сложных веществ, или так называемых молекулярных спектров. Молекула — это сложная частица, состоящая из химически связанных друг с другом атомов. У молекул спектры совсем иного вида, чем у
Физические условия изменяют спектры
Физические условия изменяют спектры Мы уже говорили, что оптические спектры зависят от тех условий, в которых находятся атомы. Сильные магнитные поля изменяют оптические спектры атомов; они расщепляют спектральные линии. Таково же действие сильных электрических полей.
Атомные часы
Атомные часы Как мы уже говорили, в 1949 г. Н. Рамси изобрел резонансную методику с разнесенными осциллирующими полями, которая в 1955 г. была использована Дж. Захариасом, Дж. Пари, Луисом Эссеном и др. для создания атомных часов и стандартов частоты. За этот метод Рамси в 1989 г.
Атомные часы
Атомные часы Было установлено, что наиболее интересным применением мазеров на атомных пучках является создание атомных часов. Очень точные часы можно использовать, чтобы установить, являются ли астрономические «константы» действительно постоянными или они изменяются