Глава 3. “Золотой” датчанин
Глава 3.
“Золотой” датчанин
Манчестер, Англия, 19 июня 1912 года, среда. “Дорогой Харальд! Похоже, мне удалось кое-что понять про структуру атомов”, — пишет Нильс Бор младшему брату1. “Не рассказывай об этом никому, — предупреждает он. — Иначе не смогу писать тебе”. Молчание было очень важно для Бора. Он надеялся, что ему удастся осуществить мечту любого физика: приоткрыть завесу, скрывающую непознанное. Надо было еще кое-что доделать. И Бор пишет: “Очень хочу доделать все поскорее. Для этого мне даже пришлось взять в лаборатории отпуск на два дня (это тоже секрет)”2. Однако двадцатишестилетнему датчанину потребовалось гораздо больше времени, чтобы доработать и изложить свои идеи в трех статьях под общим названием “О строении атомов и молекул”. Первая, опубликованная в июле 1913 года, стала поистине революционной: Бор осмелился ввести квант непосредственно внутрь атома.
Нильс Хенрик Давид Бор родился в Копенгагене в 1885 году. В этот день его матери Эллен исполнилось двадцать пять лет. Перед рождением второго ребенка она вернулась под крыло родителей. Отец Эллен, банкир и политик, был одним из самых богатых людей города. Его особняк (дом №14) на Вед Странден — широкой мощеной улице, идущей от замка Кристианборг, где заседал датский парламент, — привлекал внимание своей величественностью. Хотя родители Нильса прожили здесь недолго, этот дом стал первым в череде просторных, обставленных со вкусом домов, в которых прошла жизнь Бора.
Кристиан Бор, отец Нильса, — известный профессор физиологии Копенгагенского университета, — открыл роль диоксида углерода при вытеснении кислорода из гемоглобина и исследовал процесс дыхания. За эти работы он был номинирован на Нобелевскую премию по физиологии и медицине. С 1886 года до его безвременной кончины в 1911 году (ему было всего пятьдесят шесть) семья жила в просторной квартире, принадлежавшей университетской Академии хирургии. Эту квартиру, расположенную на одной из фешенебельных улиц, всего в десяти минутах ходьбы от школы, очень любили все дети: Дженни (она была старше Нильса на два года), Нильс и Харальд (он был моложе Нильса всего на восемнадцать месяцев3). В семье было три горничных и няня, ухаживающая за детьми. Жизнь была комфортабельной и спокойной и значительно отличалась от существования большинства жителей Копенгагена, население которого все время росло.
Благодаря положению отца и происхождению матери частыми гостями дома были ведущие ученые, философы, писатели и художники Дании. Трое из них — физик Кристиан Кристиансен, философ Харальд Геффдинг и лингвист Вильгельм Томсен — были, как и Бор-старший, членами Датской королевской академии наук и литературы. Обычно после еженедельных собраний академии обсуждение продолжалось на квартире одного из участников “квартета”. Если гости приходили в дом к Бору, то подросткам, Нильсу и Харальду, разрешалось присутствовать при этих оживленных дискуссиях. Мальчикам выпала редкая возможность узнать, что волновало интеллектуалов Европы накануне конца столетия. Как напишет позже сам Нильс, это было “одно из их самых ранних и самых сильных впечатлений”4.
В школе Нильс прекрасно успевал по математике и естественным наукам, но к языкам способностей у него не было. “В то время он не задумываясь пускал в ход кулаки, если дело доходило до драк во время школьных перемен”, — вспоминал один из друзей5. В 1903 году, когда Бор поступил в Копенгагенский университет (в то время единственный университет в Дании), чтобы изучать физику, Эйнштейн уже более трех лет служил в патентном бюро в Берне6. В 1909 году, когда Бор получил степень магистра, Эйнштейн был экстраординарным профессором теоретической физики Цюрихского университета. Тогда же его впервые номинировали на Нобелевскую премию. Бор тоже отличился, но уровень награды был совсем другим. В 1907 году, когда ему был двадцать один год, он получил золотую медаль Датской королевской академии за работу о поверхностном натяжении воды. После этого его отец, получивший в 1885 году серебряную медаль, часто повторял: “Я серебряный, а Нильс — золотой”7.
Бор стал “золотым” после того, как отец заставил его уехать из лаборатории в деревню. Только там ему удалось закончить “золотую” статью. Хотя она была передана комиссии всего за два часа до окончания приема работ, Бор все еще хотел внести кое-какие добавления. Их он передал экзаменаторам двумя днями позднее. Желание Бора переписывать любой текст до тех пор, пока он не убедится, что изложение точно соответствует тому, что он хочет сказать, граничило с одержимостью. За год до окончания докторской диссертации Бор признался, что уже написал “четырнадцать более или менее отличающихся друг от друга черновиков”8. Однажды Харальд, заметив письмо на столе Бора, предложил его отправить, но услышал: “О нет! Это только первый набросок черновика”9.
Всю жизнь братья оставались очень близкими друзьями. Кроме математики и физики, оба любили спорт, особенно футбол. Харальд, игравший лучше, завоевал в составе датской футбольной команды серебряную Олимпийскую медаль за 1908 год (в финальном матче они проиграли Англии). Многие считали его более одаренным, чем брат. Докторскую степень по математике он получил годом раньше Нильса, защитившего диссертацию по физике в мае 1911 года. Их отец, однако, всегда считал старшего сына “самым одаренным членом семьи”10.
На защиту диссертации Бор, как того требовал обычай, пришел во фраке. Его доклад оказался необычно коротким для таких собраний: он занял ровно девяносто минут. Одним из двух экзаменаторов был Кристиан Кристиансен, друг отца. Он отметил, что в Дании, к сожалению, нет физиков, “специализирующихся в области теории металлов, которые могли бы по достоинству оценить работу”11. Тем не менее степень Бору была присуждена, а копии его работы направлены таким знаменитостям, как Макс Планк и Хендрик Лоренц. Не ответил ни один, и стало понятно, что без перевода посылать ее было бессмысленно. Впрочем, вместо того чтобы перевести диссертацию на немецкий или французский (большинство физиков говорило на этих языках свободно), Бор уговорил друга перевести диссертацию на английский.
В отличие от отца, выбравшего Лейпциг, и брата, поехавшего в Геттинген (в этих немецких университетах честолюбивые датчане традиционно завершали свое образование), Нильс Бор отправился в Кембридж. Для него “сердце физики”12 находилось там, где работали Ньютон и Максвелл. Он рассчитывал, что переведенная диссертация станет его визитной карточкой, и надеялся, что ему удастся поработать с сэром Джозефом Джоном Томсоном. Об этом человеке он позднее вспоминал как о “гении, который указал путь всем”13.
В конце сентября 1911 года, после беспечного лета с катанием на яхте и пешими походами, Бор прибыл в Англию. Целый год он будет получать стипендию, учрежденную пивоваренной фирмой “Карлсберг”. “Я почувствовал, как радостно стало у меня на душе, когда, стоя перед лавкой, увидел на ее двери надпись ‘Кембридж’”, — написал Бор своей невесте Маргрет Норлунд14. Рекомендательное письмо и фамилия Бор обеспечили Нильсу теплый прием университетских физиологов, помнивших его покойного отца. Они помогли ему найти небольшую двухкомнатную квартиру на окраине города. Еще какое-то время он был “очень занят устройством, визитами и зваными обедами”15. Но затем настроение Бора испортилось: его, как и других друзей и учеников Джозефа Джона Томсона, огорчали отношения, складывавшиеся с этим человеком.
Томсон, сын книготорговца из Манчестера, был избран третьим по счету руководителем Кавендишской лаборатории. Это произошло в 1884 году, через неделю после того, как ему исполнилось двадцать восемь лет. Это назначение было совершенно невероятным. Во-первых, после Джеймса Клерка Максвелла и лорда Рэлея руководителем столь известной экспериментальной лаборатории стал совсем молодой человек. А во-вторых — один из ассистентов Томсона вспоминал, что тот “настолько не умел работать руками, что я считал необходимым не подпускать его к приборам”16. И хотя Томсон, получивший Нобелевскую премию за открытие электрона, не обладал навыками настоящего экспериментатора, коллеги утверждали, что он “обладал интуитивной способностью разобраться в деталях работы сложных приборов, даже не прикасаясь к ним”17.
Вежливая манера Томсона — хрестоматийного рассеянного профессора в круглых очках и твидовом пиджаке — помогла Бору подавить волнение при первой встрече с ним. Желая произвести впечатление, он вошел в кабинет, держа свою диссертацию и книгу Томсона. Открыв книгу, Бор указал на одно из уравнений и заявил: “Оно неправильно”18. Хотя Томсон не привык, чтобы ему так беспардонно напоминали о его прежних ошибках, он пообещал прочесть диссертацию Бора. Положив ее поверх стопки статей на своем заваленном бумагами столе, он пригласил молодого датчанина на обед в следующее воскресенье.
Неделя проходила за неделей, а диссертация оставалась непрочитанной. Воодушевление, с которым он приехал, проходило, и Бор начал нервничать. “Похоже, — писал он Харальду, — что с Томсоном не так легко иметь дело, как мне показалось сначала”19. Несмотря на это, Бор по-прежнему восхищался пятидесятилетним ученым: “Он прекрасный человек, неправдоподобно умный, обладающий невероятной фантазией (послушал бы ты хоть одну из его популярных лекций) и бесконечно дружелюбный. Но он так занят, у него сразу такое количество дел, он так погружен в работу, что к нему трудно пробиться”20. Бор знал: ему мешает плохой английский. Чтобы преодолеть языковой барьер, он начал со словарем читать “Посмертные записки Пиквикского клуба”.
В начале ноября Бор отправился навестить бывшего студента отца, который теперь был профессором физиологии в Манчестерском университете. Во время этого визита Бора представили Эрнесту Резерфорду, только что вернувшемуся с физического конгресса в Брюсселе21. Харизматичный новозеландец, вспоминал Бор много лет спустя, “говорил с присущим ему энтузиазмом о множестве новых направлений в физической науке”22. Восхищенный “живым рассказом о дискуссиях на Сольвеевском конгрессе”, Бор покинул Манчестер, очарованный Резерфордом как физиком и как человеком23.
Первого мая 1907 года на физическом факультете Манчестерского университета произошла сенсация. Всеобщее внимание привлек новый декан, искавший свой кабинет. “Резерфорд прыгал через три ступеньки. Мы только в страшном сне могли себе представить профессора, таким образом поднимающегося по лестнице”, — вспоминал позднее один из его ассистентов24. Но спустя несколько недель энергия и деловой подход тридцатишестилетнего профессора покорили его новых коллег. Именно тогда Резерфорд начал собирать команду, успехи которой, достигнутые в следующие десять лет, были невероятными. Эта группа сформировалась и благодаря личности Резерфорда, и благодаря его научному чутью и изобретательности. Он не только руководил этой группой. Он был ее сердцем.
Резерфорд, четвертый из двенадцати детей в семье, родился 30 августа 1871 года в Новой Зеландии, в деревянном домишке в поселке Спринг-Грув на севере Южного острова. Его мать была учительницей, отец — строительным рабочим. Джеймс и Марта Резерфорд делали все возможное для достижения их детьми того, что позволят им талант и удача. Шансом для Эрнеста оказались стипендии, благодаря которым он смог продолжать образование. Они в итоге и привели его на другой конец света — в Кембридж.
В октябре 1895 года, когда Резерфорд явился в Кавендишскую лабораторию, чтобы работать под началом Томсона, он вовсе не был тем жизнерадостным и уверенным в себе человеком, каким стал спустя несколько лет. Трансформация началась после того, как он продолжил начатую в Новой Зеландии работу по детектированию “беспроводных” волн (позднее их назвали радиоволнами). Резерфорду потребовалось всего несколько месяцев, чтобы усовершенствовать детектор. Он подумывал о том, чтобы заработать, но вовремя понял, что в научной среде, где патенты были редкостью, попытка использовать разработки ради корысти может повредить репутации. Никогда, даже после того, как Гульельмо Маркони заработал состояние, Резерфорд не сожалел, что забросил свой детектор. А ведь состояние Маркони могло бы принадлежать Резерфорду, если бы открытие, ставшее главной новостью мировой прессы, было сделано с помощью его детектора.
Восьмого ноября 1895 года Вильгельм Рентген обнаружил, что при пропускании тока высокого напряжения через стеклянную вакуумную трубку некое излучение вызывает свечение небольшого бумажного экрана, покрытого платино-цианистым барием. Позднее, когда пятидесятилетнего профессора физики Вюрцбургского университета спрашивали, о чем он думал, когда открыл загадочные лучи, Рентген ответил: “Я не думал, а исследовал”25. Почти шесть недель он раз за разом повторял “один и тот же эксперимент, чтобы окончательно убедиться, что лучи действительно существуют”26. Опыты подтвердили, что источником странного излучения, вызывающего флуоресценцию, была трубка27.
Рентген попросил свою жену Берту положить руку на фотопластинку и направил на нее “X-лучи” — так он назвал неизвестное излучение. Через пятнадцать минут Рентген осмотрел пластинку. Берта испугалась, увидев очертания костей, двух колец и темное пятно на месте руки. Первого января 1896 года Рентген разослал копии своей работы “Новый тип лучей” с фотографиями гирь в ящике и костей руки Берты ведущим физикам Германии и всего мира. Новость об открытии Рентгена и его удивительных фотографиях распространилась молниеносно. Через несколько дней об “X-лучах” узнали все. Фотографии кисти Берты обошли все газеты мира. О таинственных лучах за год было опубликовано сорок девять книг и тысячи научных и научно-популярных статей28.
Томсон приступил к изучению X-лучей еще до того, как 23 января в еженедельном научном журнале “Нейчур” появился английский перевод статьи Рентгена. Тогда Томсон занимался исследованием электропроводности газов. X-лучи привлекли его внимание, когда он услышал, что они делают газ проводником. Томсон быстро проверил это утверждение и попросил Резерфорда помочь ему выяснить, что происходит с газом при прохождении X-лучей. По результатам этой работы Резерфорд в следующие два года опубликовал четыре статьи, которые принесли ему международную известность. Первую Томсон предварил небольшим введением, в котором высказал предположение, что, как и свет, X-лучи являются формой электромагнитного излучения. Это предположение подтвердилось позднее.
Пока Резерфорд ставил свои опыты, француз Анри Беккерель искал ответ на вопрос, испускают ли X-лучи и светящиеся в темноте фосфоресцирующие вещества. Вместо этого он обнаружил излучение соединений урана (независимо от того, фосфоресцируют они или нет). Сообщение Беккереля об открытии “урановых лучей” осталось почти незамеченным. Считалось, что такие лучи могут испускать только соединения урана, и поэтому они мало кого заинтересовали. Среди этих немногих оказался Резерфорд: он собрался выяснить, влияют ли эти лучи на электропроводность газов. Позднее ученый говорил, что это было самым важным решением за всю его жизнь.
Резерфорд исследовал глубину проникновения урановых лучей, используя очень тонкие слои фольги из “голландского металла” — сплава меди с цинком. Оказалось, что интенсивность прошедшего излучения зависит от числа слоев фольги.
Сначала при увеличении их числа интенсивность падала, затем добавление новых слоев практически не влияло на ее величину, однако потом интенсивность удивительным образом опять начинала уменьшаться. Повторив эксперименты с фольгой из разных материалов, Резерфорд отметил тот же эффект. Он смог предложить лишь одно объяснение: существуют два типа излучения — Резерфорд назвал его альфа- и бета-лучами.
Когда немецкий физик Герхард Шмидт объявил, что торий и его соединения тоже испускают излучение, Резерфорд сравнил их с альфа- и бета-лучами. Он обнаружил, что излучение тория мощнее, и пришел к выводу, что в этом случае “присутствуют более проникающие лучи”29, позднее названные гамма-лучами30. Мария Кюри ввела термин “радиоактивность” для описания процесса излучения и назвала вещества, испускающие “беккерелевские лучи”, радиоактивными. Она считала, что поскольку радиоактивность наблюдается не только у урана, это явление должно быть связано с атомами. Уверенность в этом позволила Марии Кюри и ее мужу Пьеру открыть такие радиоактивные элементы, как радий и полоний.
В апреле 1898 года, когда в Париже вышла первая работа супругов Кюри, Резерфорд узнал, что в Университете Мак-Гилла в Монреале объявлен конкурс на замещение должности профессора физики. Хотя благодаря работам по радиоактивности он уже был признанным авторитетом, Резерфорд мало надеялся на успех, несмотря на рекомендацию Томсона: “У меня никогда не было столь преданного работе и самостоятельного ученика, как мистер Резерфорд. Я уверен, что если он получит это место, ему удастся создать в Монреале блестящую физическую школу... Считаю, что для любого университета было бы большой удачей иметь возможность предоставить мистеру Резерфорду место профессора физики”31. В конце сентября двадцатисемилетний Резерфорд приехал в Монреаль. Там он провел следующие девять лет.
Резерфорд, покидая Англию, уже знал, что “от него ожидают большого числа новых работ и создания научной школы, способной посрамить янки”32. С этой задачей он справился. Первое открытие, сделанное Резерфордом в Канаде, касалось радиоактивности тория. Ученый показал, что в течение минуты она уменьшается в два раза, затем еще в два раза за следующую минуту. Через восемь минут интенсивность радиоактивного излучения уменьшается в восемь раз относительно исходного значения33. Описывая закон уменьшения радиоактивности в зависимости от времени, Резерфорд ввел понятие периода полураспада, то есть времени, которое необходимо, чтобы интенсивность радиоактивного излучения уменьшилась вдвое. А затем последовало открытие, которое принесло ему место профессора в Манчестере и Нобелевскую премию.
В октябре 1901 года Эрнест Резерфорд и двадцатипятилетний английский химик Фредерик Содди, живший в Монреале, начали совместно исследовать радиоактивность тория. Вскоре они поняли, что торий, вероятно, превращается в другой элемент. Содди вспоминал, как он остолбенел и у него вырвалось: “Это же трансмутация”. “Ради всего святого, Содди, не называйте это трансмутацией, — воскликнул Резерфорд. — Нас распнут как алхимиков”34.
Однако скоро они оба убедились, что на самом деле радиоактивность представляет собой превращение одного элемента в другой за счет испускания излучения. Сначала их еретическую теорию восприняли очень скептически, но экспериментальные данные оказались решающими. Критикам пришлось отказаться от столь милого всем представления об устойчивости материи. Это уже была не мечта алхимиков, а научно установленный факт: все радиоактивные элементы самопроизвольно превращаются в другие элементы, а период полураспада — это время, которое требуется для того, чтобы половина атомов претерпела такое превращение.
“Молодой, энергичный, похожий на мальчишку, он напоминал кого угодно, только не ученого, — вспоминал о Резерфорде Хаим Вейцман, тогда преподаватель химии в Манчестерском университете, позднее первый президент Израиля. — Он охотно и убежденно говорил о чем угодно, иногда не имея понятия о предмете разговора. Спускаясь вниз в столовую на ланч, я слышал в коридоре... раскаты его голоса”35. Вейцман полагал, что Резерфорд, “полностью поглощенный своей наукой, открывшей новую эру в естествознании, был начисто лишен политического чутья и вообще политикой не интересовался”36. Центральное место в работе Резерфорда занимало “прощупывание” атомов с помощью ?-частиц.
Но что представляют собой ?-частицы? Это долго смущало Резерфорда даже после того, как он понял, что на самом деле ?-лучи — положительные частицы, направление движения которых меняется в сильном магнитном поле. Он считал, что ?-частица — это ион гелия, то есть атом гелия, потерявший два электрона, но поскольку доказательствами он располагал лишь косвенными, то никогда не говорил этого публично. И вот теперь, почти десять лет спустя после открытия ?-лучей, он надеялся найти окончательный ответ на вопрос, что такое ?-частицы. Про ?-частицы уже давно стало понятно, что они суть быстро двигающиеся электроны. Летом 1908 года Резерфорд с помощью двадцатипятилетнего немца Ганса Гейгера получил подтверждение своей старой гипотезы: ?-частица действительно является атомом гелия, потерявшим два электрона.
“Дьявол кроется в рассеянии”, — говорил Резерфорд, когда они с Гейгером пытались “сорвать маску” с ?-частиц37. Двумя годами ранее в Монреале он уже обратил внимание на то, что некоторые ?-частицы, проходя через слюдяную пластинку, несколько отклоняются от прямолинейной траектории, из-за чего на фотопластинке появляется размытое пятно. Резерфорд решил выяснить причину этого. Вскоре после приезда в Манчестер он наметил список тем, которыми следовало бы заняться. Одну из них — рассеяние ?-частиц — он предложил Гейгеру.
Вместе они разработали схему простого эксперимента. Они собирались подсчитать число сцинтилляций — небольших вспышек света, вызванных ?-частицами, которые, пройдя через листок тонкой золотой фольги, ударяются в бумажный экран, покрытый сульфидом цинка. Считать сцинтилляции, проводя долгие часы в полной темноте, было очень трудно. К счастью, по словам Резерфорда, “Гейгер был гениальным исполнителем и мог, не теряя самообладания, считать хоть целую ночь напролет”38. Гейгер обнаружил, что ?-частицы либо проходят через фольгу и не меняют направления, либо отклоняются на один-два градуса. Этого и следовало ожидать. Удивительно было другое: Гейгер заметил, что некоторые ?-частицы “отклоняются на существенно больший угол”39.
Еще до того, как Резерфорд полностью разобрался в том, что означают результаты Гейгера и имеют ли они вообще смысл, ему была присуждена Нобелевская премия по химии “за проведенные исследования в области распада элементов в химии радиоактивных веществ”. Забавная сторона этого события состоит в том, что человек, полагавший, что “наука может быть либо физикой, либо коллекционированием марок”, претерпел неожиданное превращение из физиков в химики40. После возвращения из Стокгольма Резерфорд-лауреат научился вычислять вероятности рассеяния ?-частиц на разные углы. Расчеты показали, что очень мал (практически равен нулю) шанс, что ?-частица, проходя через золотую фольгу, многократно рассеется: это в результате могло бы привести к большому углу отклонения.
Именно тогда, когда Резерфорд был погружен в эти вычисления, Гейгер предложил привлечь к работе подающего надежды студента Эрнеста Марсдена. “Почему бы нет? Пусть выяснит, могут ли ?-частицы рассеиваться на большие углы”, — сказал Резерфорд41. И очень удивился, когда Марсден обнаружил, что это возможно. Поиск продолжался. Углы рассеяния все увеличивались, но, согласно расчетам, рассеяния на такие большие углы вообще не могло быть: зарегистрированных Марсденом вспышек света, указывающих на то, что ?-частицы попадают на покрытый сульфидом цинка экран, не должно было быть видно.
Пытаясь понять “природу гигантских электрических или магнитных сил, способных повернуть или рассеять пучок ?-частиц”, Резерфорд попросил Марсдена проверить, могут ли ?-частицы рассеиваться назад42. Он не ожидал, что Марсден вообще что-нибудь увидит, и был крайне удивлен, когда Марсден обнаружил: некоторые ?-частицы отскакивают от золотой фольги. “Это невообразимо! — отозвался Резерфорд. — Это столь же невероятно, как если бы вы попали пятнадцатидюймовым снарядом в бумажную салфетку, а он отскочил бы и попал в вас”43.
Гейгер и Марсден сравнили результаты экспериментов, в которых использовались разные металлы. Оказалось, что золото рассеивает обратно в два раза больше ?-частиц, чем серебро, и в двадцать раз больше, чем алюминий. От платиновой фольги отскакивает лишь одна из восьми тысяч ?-частиц. В статье, опубликованной в июне 1909 года, Гейгер и Марсден безо всяких комментариев подробно описали эксперимент и его результаты. Сбитому с толку Резерфорду потребовалось еще восемнадцать месяцев на решение этой загадки.
Весь XIX век вокруг существования атомов велись непрерывные научные и философские дебаты. Но к 1909 году неоспоримые доказательства их реальности уже появились. Критикам атомарной теории пришлось уступить давлению неопровержимых фактов. Доказательства основывались прежде всего на экспериментально подтвержденной модели броуновского движения Эйнштейна и открытом Резерфордом распаде радиоактивных элементов. После десятилетий споров, участие в которых принимали многие видные физики и химики, наиболее приемлемой была признана модель атома, предложенная в 1903 году Джозефом Джоном Томсоном, — “пудинг с изюмом”.
Томсон считал, что атом — это не обладающий массой положительно заряженный шар, в котором, как изюмины в пудинге, распределены отрицательно заряженные электроны. Электроны были открыты Томсоном шестью годами ранее. Положительный заряд компенсирует силы отталкивания, действующие между электронами, которые в противном случае разорвали бы атом на части44. В атоме каждого элемента, предполагал Томпсон, электроны распределены по собственному, характерному для данного элемента набору концентрических окружностей. Различное число и способ расположения электронов, например в золоте и свинце, отличают их. Поскольку в атоме Томсона массой обладают только электроны, то даже в самых легких из них должно было быть несметное количество электронов.
Ровно за сто лет до этого, в 1803 году, английский химик Джон Дальтон впервые высказал идею о том, что атом каждого элемента однозначно характеризуется его весом. Прямого метода измерения атомных весов у него не было, поэтому он определял только их относительные значения, анализируя пропорции, в которых элементы объединяются, образуя соединения. Для сравнения Дальтону нужен был эталон. Поскольку водород — самый легкий из известных элементов, он положил его атомный вес равным единице. После этого атомные веса остальных элементов можно было сравнивать с атомным весом водорода.
Томсон, изучив результаты экспериментов по рассеянию рентгеновских лучей и ?-частиц атомами, пришел к выводу, что его модель неверна: он переоценил число электронов. Согласно новым расчетам Томсона, атом не может иметь больше электронов, чем ему предписывает атомный вес. Точное число электронов в атоме было неизвестно, но предложенный Томсоном способ определения их максимально возможного числа ученые сразу расценили как шаг в правильном направлении. У атома водорода, атомный вес которого равен единице, может быть только один электрон. Однако атом гелия с атомным весом четыре может иметь два, три, даже четыре электрона. У других элементов допустимое число электронов определялось точно так же.
Катастрофическое уменьшение числа электронов означало, что вес атома должен определяться главным образом весом сферы, по которой размазан положительный заряд. Неожиданно сфера, которую Томсон придумал как трюк, способный обеспечить стабильность и нейтральность атома, стала реальностью. Но даже эта новая усовершенствованная модель не могла объяснить рассеяние ?-частиц и не позволяла определить точное число электронов в каждом из атомов.
Резерфорд был уверен, что ?-частицы рассеиваются из-за наличия внутри атома чрезвычайно сильного электрического поля. Но в атоме Томсона, где положительный заряд равномерно размазан по всему атому, нет настолько интенсивного электрического поля. Альфа-частица, ударившись о такой атом, просто не может отлететь обратно. В декабре 1910 года Резерфорду удалось “сконструировать атом неизмеримо лучше атома Дж. Дж. [Томсона]”45. “Теперь я знаю, — заявил он Гейгеру, — на что похож атом”46. На томсоновский он совсем не был похож.
Атом Резерфорда состоит из крошечного, расположенного в центре положительно заряженного ядра, в котором сосредоточена практически вся масса атома. Ядро примерно в сто тысяч раз меньше самого атома. Его можно сравнить с “мухой в соборе”47. Резерфорд понимал, что электроны атома не могут нести ответственность за отклонение ?-частиц, поэтому ему не надо было точно знать, как они располагаются вокруг ядра. Он однажды пошутил, что атом уже не был, как его учили, тем “чудным несгибаемым парнем красного или серого цвета, какой вам приглянется”48.
При любом “столкновении” большинство ?-частиц, не отклоняясь от своего пути, пролетит через атом Резерфорда: они не почувствуют влияния крошечного ядра в центре, от которого окажутся слишком далеко. Другие лишь слегка изменят направление, испытав слабое воздействие электрического поля ядра. Чем ближе к ядру оказывается проходящая через атом ?-частица, тем сильнее воздействует на нее электрическое поле и тем сильнее она отклоняется от начальной траектории. Но если ?-частица испытывает столкновение с ядром, действующая между ними сила отталкивания отбросит эту частицу строго назад, как мяч, ударяющийся о стенку. Гейгер и Марсден показали, что такие отскоки случаются чрезвычайно редко. Резерфорд говорил, что это “похоже на стрельбу по мошке, летающей вечером в Альберт-холле”49.
Модель Резерфорда позволяла получить простую формулу, точно предсказывающую, какую долю ?-частиц можно обнаружить при любом угле рассеяния. Резерфорд не хотел делать свою модель атома достоянием гласности, пока не будет тщательно исследовано распределение по углам рассеянных ?-частиц. Гейгер взялся за решение этой задачи и обнаружил, что распределение ?-частиц полностью согласуется с теоретическими выкладками Резерфорда.
Седьмого марта 1911 года Резерфорд представил свою модель атома в докладе, сделанном на заседании Манчестерского литературного и философского общества. А четыре дня спустя он получил письмо от профессора университета в Лидсе Уильяма Генри Брэгга. Тот писал, что “пятью или шестью годами ранее” японский физик Хантаро Нагаока предложил модель атома с “большим, положительно заряженным центром”50. Он не знал, что прошлым летом Нагаока во время поездки по ведущим лабораториям Европы был и у Резерфорда. Не прошло и двух недель после получения письма Брэгга, как пришло и письмо из Токио. Нагаока, поблагодарив за “сердечный прием в Манчестере”, указывал, что в 1904 году он предложил “модель атома типа Сатурна”51. Согласно этой модели атом состоит из большого тяжелого центра, вокруг которого по круговым орбитам вращаются электроны52.
“Предлагаемая мною структура атома чем-то напоминает Вашу, представленную в опубликованной несколько лет назад работе”, — поблагодарил Резерфорд в ответном письме. Однако, несмотря на сходство моделей, между ними было очень важное отличие. В модели Нагаоки тяжелая положительно заряженная центральная часть занимала почти весь плоский, похожий на блин атом. А в сферической модели Резерфорда крошечное положительно заряженное ядро, сосредоточившее в себе практически всю массу атома, расположено в его центре, а сам атом остается практически пустым. Но у обеих моделей имелся неустранимый дефект, из-за которого практически никто из физиков не отнесся к ним серьезно.
Дело в том, что атом, у которого неподвижные электроны расположены вокруг положительно заряженного ядра, нестабилен: отрицательно заряженные электроны неудержимо притягиваются к ядру. Если же они вращаются вокруг ядра наподобие планет, вращающихся вокруг Солнца, атом все равно разрушится. Еще Ньютон показал, что движение по кругу всегда происходит с ускорением. А согласно теории Максвелла, если заряженная частица, каковой является электрон, движется с ускорением, она излучает электромагнитные волны и непрерывно теряет энергию. Вращающийся вокруг ядра электрон, двигаясь по спирали, упадет на ядро за время порядка одной тысячной от одной миллиардной секунды. Само существование материального мира свидетельствовало против наличия ядра у атома.
Резерфорд давно знал об этой, казалось, непреодолимой трудности. В книге “Радиоактивные превращения”, изданной еще в 1906 году, он писал: “Неизбежная потеря энергии двигающимся с ускорением электроном вызывает наибольшие затруднения при попытке понять устройство стабильного атома”53. Но в 1911 году он предпочел не обращать внимания на эту трудность: “На этой стадии не стоит останавливаться на вопросе о стабильности атома. Она, очевидно, определяется мгновенной структурой атома и движением составляющих его заряженных частей”54.
В первый раз Гейгер проверил формулу рассеяния Резерфорда быстро и недостаточно тщательно. Теперь вместе с Марсденом он потратил на измерения почти год. К июлю 1912 года результаты полностью подтвердили и саму формулу, и основные выводы теории Резерфорда55. Пройдут годы, и Марсден напишет: “Эта тотальная проверка была трудоемкой, но захватывающей задачей”56. В процессе работы они также поняли, что, с учетом ошибки эксперимента, заряд ядра атома данного элемента приблизительно равен половине его атомного веса. Это означало, что за исключением водорода, атомный вес которого равен единице, число электронов в атомах всех других элементов тоже должно приблизительно равняться половине атомного веса. Теперь можно было определить точное число электронов, например, в атоме гелия. Оно равно двум, а не двум, или трем, или четырем, как ранее предполагалось. Однако уменьшение числа электронов означало, что атом Резерфорда должен излучать энергию еще интенсивнее.
Когда Резерфорд подробно пересказывал Бору все, что обсуждалось на I Сольвеевском конгрессе, он забыл отметить, что в Брюсселе ни он, ни другие не упоминали теорию ядра атома Бора.
Сотрудничество с Томсоном, о котором мечтал Бор в Кембридже, не сложилось. Много позднее Бор назвал одну из возможных причин неудачи: “Я недостаточно хорошо знал английский и поэтому не знал, как выразить свои мысли. Я мог только указать на ошибку, но, похоже, он не нуждался в подобных указаниях”57. Томсон вообще имел дурную репутацию человека, не читающего работ и писем своих студентов и коллег. Кроме того, к этому времени он уже перестал активно интересоваться физикой электронов.
Чары Томсона развеялись. В начале декабря Бор еще раз столкнулся с Резерфордом на традиционной ежегодной встрече аспирантов Кавендишской лаборатории — шумной вечеринке с тостами, песнями и чтением лимериков, заканчивавшейся обедом из десяти перемен. Резерфорд опять произвел на Бора сильное впечатление, и последний всерьез задумался, не поменять ли Кембридж и Томсона на Манчестер и Резерфорда. Через месяц он поехал в Манчестер, чтобы обсудить эту возможность с Резерфордом. Молодой человек, решившийся на целый год разлучиться со своей невестой, отчаянно пытался сделать нечто очень важное, что могло бы оправдать его. Бор сказал Томсону, что хочет “понять, что такое радиоактивность”, и получил разрешение оставить Кембридж в конце нового семестра58. “В Кембридже, — заметил он много лет спустя, — было очень интересно, но время было потрачено абсолютно впустую”59.
Бору оставалось провести в Англии всего четыре месяца, когда в середине марта 1912 года он приехал в Манчестер. Здесь он собирался прослушать семинедельный курс по технике экспериментов с радиоактивными веществами. Времени было очень мало, и все вечера Бор проводил, пытаясь понять, как физика электронов может помочь лучше разобраться в свойствах металлов. Под руководством Гейгера и Марсдена он успешно окончил курс, и Резерфорд предложил ему выполнить небольшое самостоятельное исследование.
“Резерфорд — человек, в котором невозможно ошибиться, — писал Бор Харальду. — Он регулярно заходит, чтобы поинтересоваться, как идут дела, и обсудить все до мельчайших подробностей”60. В отличие от Томсона, совсем, по мнению Бора, не обращавшего внимания на учеников, Резерфорд “интересуется работой всех своих сотрудников”. Он обладал сверхъестественной способностью распознавать таланты. Одиннадцать его учеников и несколько соавторов стали лауреатами Нобелевской премии. Когда Бор появился в Манчестере, Резерфорд написал одному из друзей: “Бор, датчанин, выбрался из Кембриджа и явился сюда, чтобы поучиться работать с радиоактивностью”61. Тогда Бор еще не сделал ничего такого, что отличало бы его от энергичных молодых людей, работавших в лаборатории Резерфорда, кроме одного — он был теоретиком.
Вообще-то Резерфорд не очень ценил теоретиков и никогда не упускал возможности пройтись на их счет. “Они играют со своими символами, — сказал он однажды коллеге, — а мы добываем действительно неоспоримые факты, объясняющие устройство природы”62. Другой раз, когда его пригласили прочесть лекцию о направлениях развития современной физики, он ответил: “Я не могу прочесть целую лекцию об этом. Единственное, что я мог бы сказать, так это то, что физики-теоретики подняли головы, и самое время нам, экспериментаторам, помочь им опустить их”63. Однако двадцатишестилетнего датчанина он сразу полюбил: “Бор другой. Он играет в футбол”64.
Каждый день к вечеру работа в лаборатории останавливалась. Все аспиранты и сотрудники собирались поболтать за чаем, к которому подавались пирожные и бутерброды. Резерфорд посещал эти собрания. Он восседал в кресле и был готов поддержать разговор на любую тему. Чаще всего, впрочем, говорили о физике, в частности об атомах и радиоактивности. Резерфорду удалось создать на этих собраниях атмосферу открытости и дружелюбия, и там никто не боялся говорить — даже новички. Душой компании был Резерфорд. Бор знал, что он всегда готов “выслушать любого юнца, когда было ясно, что у него на уме хоть что-то есть”65. Единственное, чего не выносил Резерфорд, так это “напыщенности”. Говорить на этих собраниях Бору нравилось.
В отличие от Эйнштейна, свободно говорившего и писавшего, Бор (неважно, говорил ли он по-датски, по-английски или по-немецки) часто останавливался и подбирал слова. Бывало, во время разговора Бор просто думал вслух, пытаясь прояснить для себя какой-то вопрос. Именно за чаем он познакомился с Дьёрдем (Георгом Карлом) фон Хевеши, который в 1943 году получил Нобелевскую премию по химии за работу по использованию изотопов в качестве меченых атомов при изучении химических процессов. Его работы широко используются для диагностики в медицине, они нашли широкое применение в химии и биологии.
Чужие в стране, языком которой им еще предстояло по-настоящему овладеть, они быстро стала друзьями. Их дружба длилась всю жизнь. “Он знал, как помочь иностранцу”, — сказал о Хевеши Бор, вспоминая, как этот молодой человек, всего на несколько месяцев старше его, помог ему включиться в жизнь лаборатории66. Именно разговоры с Хевеши, рассказавшим Бору, что число открытых новых радиоактивных элементов уже таково, что в периодической таблице для них не хватает места, заставили его задуматься о том, как устроены атомы. Даже названия этих “радиоэлементов”, появляющихся в большом количестве при радиоактивном распаде атомов, отражали некоторую неуверенность и замешательство в определении их истинного места в мире атомов. Это были уран X, актиний В, торий С и другие. Но, как сказал Хевеши, возможно, у этой проблемы есть решение. Его предложил Фредерик Содди, работавший в Монреале с Резерфордом.
В 1907 году стало ясно, что два элемента, получающиеся при радиоактивном распаде (торий и радиоактивный торий) обладают разными физическими, но абсолютно идентичными химическими свойствами. Чтобы разделить их, ставились различные химические опыты, но все безрезультатно. В течение нескольких последующих лет был открыт еще ряд таких неразделяемых химически элементов. Фредерик Содди, обосновавшийся к тому времени в Глазго, предположил: атомный вес — единственное, что отличает эти новые радиоактивные элементы от их известных “полных химических аналогов”67. Они напоминают близнецов, вес которых немного отличается.
В 1910 году Содди высказал предположение, что неразделимые химическими методами радиоактивные элементы (позднее он назвал их изотопами) — просто разные формы одного и того же элемента, и поэтому все они должны занимать одну и ту же клетку в периодической таблице68. Эта идея противоречила принятым правилам размещения элементов в периодической таблице: элементы располагались в порядке возрастания их атомного веса. Первым был водород, последним — уран. Но тот факт, что и радиоторий, и радиоактиний, и ионий, и уран X с точки зрения химии идентичны торию, убедительно свидетельствовал в пользу существования изотопов Содди69.
До разговоров с Хевеши Бор не проявлял интереса к модели атома Резерфорда. Но теперь у него возникла идея: различать атомы только по их физическим и химическим свойствам недостаточно, надо учитывать и различие ядер атомов. Не обращая внимания на неизбежность коллапса атома с ядром, Бор отнесся к модели Резерфорда с полной серьезностью и попытался согласовать наличие изотопов с использованием атомных весов для упорядочения периодической таблицы. “После этого, — скажет он позднее, — все встало на свои места”70.
Бор понял, что число электронов в атоме Резерфорда задается зарядом ядра. Поскольку атом нейтрален, то есть не обладает отличным от нуля зарядом, очевидно, что положительный заряд ядра должен компенсироваться суммарным отрицательным зарядом всех его электронов. Поэтому атом водорода в модели Резерфорда должен состоять из ядра с зарядом плюс один и одного электрона с зарядом минус один.
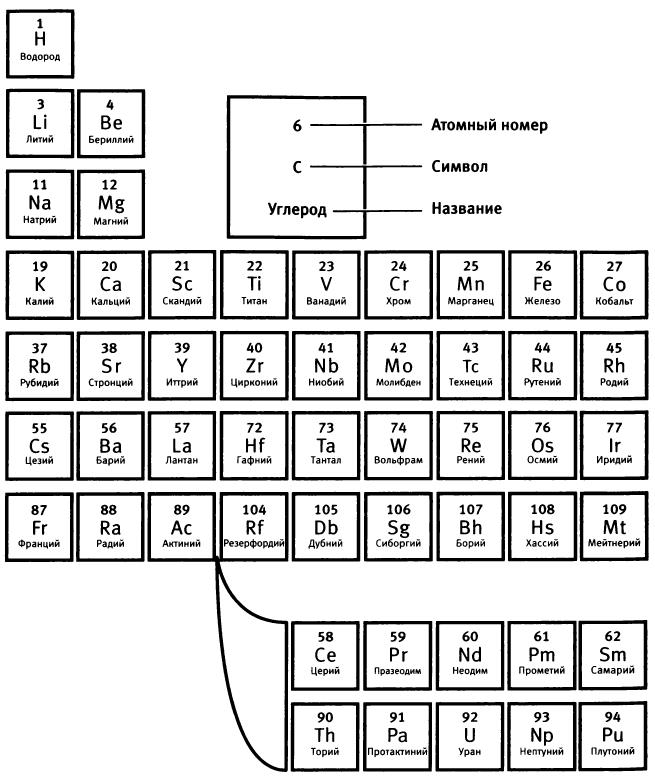
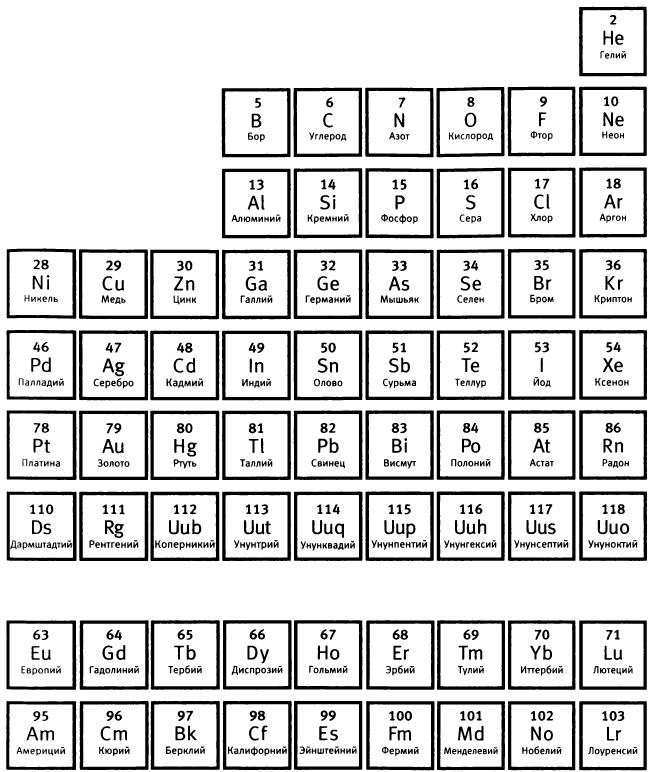
Рис. 5. Периодическая таблица химических элементов (Летом 2012 года Международный союз теоретической и прикладной химии утвердил названия элементов 114 и 116: флеровий (Н) и ливерморий (Lv). - Прuм. ред.)
Атом гелия, заряд ядра которого равен плюс двум, должен содержать два электрона. Увеличение заряда ядра при одновременном увеличении числа электронов позволяло выстроить по порядку элементы от водорода до самого тяжелого известного в то время элемента — урана (заряд ядра равен 92).
Бору было очевидно, что именно заряд ядра определяет положение атома в периодической таблице. Отсюда оставался один шаг до теории изотопов. Именно Бор, а не Содди, понял, что заряд ядра, а не атомный вес объединяет радиоактивные элементы, обладающие одинаковыми химическими, но различными физическими свойствами. Периодическая таблица может вместить и радиоактивные элементы — надо только расположить их в соответствии с зарядом их ядра.
Теперь Бор смог объяснить, почему Хевеши не удается разделить свинец и радий D. Если электроны определяют химические свойства, то любые два элемента с одинаковым числом и одинаковой конфигурацией электронов будут химически неразличимы. Так, свинец и радий D имеют один и тот же заряд ядра (82) и поэтому одно и то же число электронов (82), что делает идентичными их химические свойства. При этом свинец и радий D отличаются по своим физическим свойствам, поскольку различны массы их ядер. Масса ядра свинца примерно равна 207, радия D — 210. Отсюда Бор вывел, что радий D — это изотоп свинца и поэтому не может быть отделен от него при химических экспериментах. Позднее все изотопы стали называть так, как и элементы, изотопами которых они являются. Указывают только атомный вес изотопа: так, радий D — это свинец-210.
Бор ухватил суть: радиоактивность — явление, связанное с ядрами, а не с атомами. Это позволило ему объяснить на ядерном уровне процесс радиоактивного распада, когда один радиоактивный элемент превращается в другой с испусканием ?-, ?- или ?-излучения. Бор отдавал себе отчет в том, что если радиоактивность связана с ядерными процессами, то при превращении ядра урана с зарядом плюс 92 в уран X путем испускания ?-частицы теряются две единицы положительного заряда и образуется ядро с зарядом плюс 90. Это новое ядро не может удержать все 92 электрона свинца, поэтому оно быстро теряет два из них, что приводит к появлению нового нейтрального атома. Каждый новый атом, образующийся в результате радиоактивного распада, чтобы остаться нейтральным, немедленно приобретает либо теряет электроны. Уран X с зарядом ядра плюс 90 является изотопом тория. Они оба, объяснял Бор, “обладают одним и тем же зарядом ядра и отличаются только массой и внутренней структурой ядер”71. Именно поэтому не удается разделить торий (атомный вес 232) и уран X, то есть торий-234.
Теория Бора описывала, что происходит на ядерном уровне при радиоактивном расщеплении элементов. Из нее, скажет Бор позднее, следовало, что “при радиоактивном распаде элемент, совершенно независимо от изменения его атомного веса, может сдвинуться со своего места в периодической таблице на две клетки назад или на одну клетку вперед. Это означает уменьшение или увеличение заряда ядра, сопровождающееся испусканием, соответственно, ?- или ?-лучей”72. Уран, распадающийся с испусканием альфа-частицы, превращается в торий-234 и переходит на две клетки назад в периодической таблице.
Бета-частицы, представляющие собой быстрые электроны, обладают отрицательным зарядом, равным минус единице. Если ядро испускает одну ?-частицу, то его положительный заряд увеличивается на единицу. Это похоже на то, как если бы две частицы, одна заряженная положительно, а другая — отрицательно, мирно существовали в виде нейтральной пары, которая разрывается на части, испуская электрон и оставляя положительно заряженный осколок. Ядро нового атома, образующегося при ?-распаде, обладает зарядом на единицу больше, чем распавшийся атом, и, следовательно, сдвигается в периодической таблице на одну клетку вперед.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
IV. Каким образом частицы набирают весь свой вес? Золотой век кварков
IV. Каким образом частицы набирают весь свой вес? Золотой век кварков (t = от 10-12 до 10-8 секунды)Заглядывая все дальше в прошлое, мы наблюдаем общую тенденцию. Вселенная становится все горячее и горячее, частицы — все энергичнее и энергичнее, а это обычно означает, что они
Глава 2
Глава 2 Огненный дух «земного электричества»Открытия Гальвани и Вольты никого не оставили равнодушным. Ведь подумать только, без всяких движущихся механических частей, на одном таинственном химическом процессе можно создать источник электрической силы! Такой простой
7 ЗОЛОТОЙ ВЕК
7 ЗОЛОТОЙ ВЕК глава, в которой выясняется, что черные дыры вращаются и пульсируют, запасают и высвобождают энергию, но не имеют волосВремя действия — 1975-й год, место действия — Университет Чикаго, в южной части города, недалеко от берега озера Мичиган. Здесь, в угловом
Глава 6
Глава 6 Миртильвиль строился в чрезвычайных обстоятельствах, и это отразилось в его бесхитростной архитектуре. Когда транспортное облако, на котором спасались беженцы из Северного королевства, застыло над вулканом посреди океана, облакостроителям пришлось действовать
Глава 14
Глава 14 Незаметно махнув рукой Тому, Тристам занял свое обычное место в последнем ряду. Миртиль бросила беглый взгляд на его руку: вчерашний ожог зажил. Джерри, сидевший рядом с Томом, был вне себя от ярости. Опять этот Тристам дешево отделался! Безобразие! Давно пора
Глава 1
Глава 1 Тристам и Том летели очень высоко, много выше, чем поднимаются облака естественного происхождения. С тех пор как они оставили позади льдистую пелену, с которой на Миртильвиль обрушились войска тирана, прошел не один час.Небо здесь было не таким, как над их городком:
Глава 2
Глава 2 В небе мерцали звезды Млечного Пути. С начала полета Том не проронил ни слова, но Тристам почувствовал, что его приятель уже не так хмур, как прежде.— Ночью Солнце освещает другую сторону Земли, — неожиданно заговорил Том.Тристам обернулся.— О чем ты?— О небе. Ты
Глава 3
Глава 3 Светало. Космос и звезды постепенно исчезали. Небо наполнялось светом и утрачивало прозрачность. Стало очень, очень холодно. И очень тихо: казалось, ничто не предвещало неприятностей. Том и Тристам спали. Они не видели, что на пульте управления уже давно мигает
Глава 4
Глава 4 — Приходит в себя, — произнес женский голос.Тристам открыл глаза. Он лежал на кровати, возле которой стояли трое: мужчина и две женщины. Потолок комнаты, где он находился, был выкрашен в темно-зеленый цвет. Стены тоже были зелеными, но более светлого оттенка.Окон не
Глава 5
Глава 5 Когда дверь больницы открылась и выпустила конвой наружу, Тристам невольно зажмурился от яркого света. Вершины облачного семигорья, окружавшего город, сверкали такой чистой и ослепительной белизной, что ему пришлось идти за полицейскими с закрытыми глазами. Так,
Глава 6
Глава 6 Тюрьма, со слепыми, без единого окна, стенами, размещалась глубоко в недрах облака, на котором была построена Белая Столица. Оказавшись в камере, напуганные Тристам и Том какое-то время молча сидели на кровати, отведенной им на двоих, — в действительности это были
Глава 7
Глава 7 Прошло несколько часов. Тристам и Том лежали на жестких нарах в темной камере без окон, непрестанно ворочаясь с боку на бок. Лишь только напев флейты смолк, старик сразу задремал, что-то неразборчиво бормоча во сне.Тома снова начало знобить; Тристама же разбирал
Глава 8
Глава 8 С прохладным и сыроватым рассветным воздухом смешивался густой дым, валивший из печных труб. На всех перекрестках в центре Белой Столицы были расставлены люди снегобоя. Они походили не столько на стражей порядка, сколько на оккупационные войска.Тристам и Том в