Гибридные атомные орбитали: тетраэдрические молекулы
В молекуле метана углерод создаёт четыре связи с четырьмя атомами водорода. Как говорилось выше и показано на рис. 14.1 и 14.2, молекула метана имеет форму тетраэдра. На рис. 14.4 видно, что для создания четырёх валентных связей, совместно использующих электронные пары, углерод поднимает один из своих 2s-электронов на 2p-орбиталь. В результате у него появляется четыре неспаренных электрона на 2s-, 2px-, 2py- и 2pz-орбиталях. При обсуждении рис. 14.4 уже довольно подробно объяснялось, что эти четыре атомные орбитали не могут породить одинаковые связи с четырьмя атомами водорода и привести к появлению тетраэдрической молекулы. Поэтому 2s-, 2px-, 2py- и 2pz-орбитали объединяются в четырёх различных комбинациях и образуют четыре гибридные атомные орбитали: spa3, spb3, spc3 и spd3. Обозначение sp3 указывает на то, что каждая из четырёх гибридных атомных орбиталей является комбинацией s-орбитали и трёх различных p-орбиталей.
На рис. 14.8 показано, что четыре sp3-орбитали перекрываются с четырьмя 1s-орбиталями атомов водорода. Изображены только положительные лепестки sp3-орбиталей. Каждая из них имеет небольшой отрицательный лепесток, направленный в сторону, противоположную положительному лепестку, аналогично тому, как это показано на среднем изображении рис. 14.7 для sp2-орбиталей. Орбитали, изображённые штриховыми кривыми, лежат в плоскости страницы. Орбиталь, показанная сплошной кривой, выступает под углом над плоскостью страницы, а орбиталь, показанная штрихпунктирной линией, уходит под углом за плоскость страницы. Угол между любой парой sp3-лепестков составляет 109,5°, что обеспечивает правильную тетраэдрическую форму, о которой говорилось при обсуждении рис. 14.1 и 14.2.
На рис. 14.2 изображены молекулы метана, аммиака и воды. Как уже говорилось, все они имеют тетраэдрическую форму, если включить в рассмотрение неподелённые пары, но молекулы аммиака и воды имеют форму не совсем правильных тетраэдров. Подобно метану, аммиак и вода также используют sp3-гибридизацию для образования связей. Азот в аммиаке NH3 имеет пять валентных электронов. Два из них образуют неподелённую пару. Она не участвует в образовании химических связей. Азот использует три из своих четырёх гибридных sp3-орбиталей для соединения с тремя атомами H. Четвёртая sp3-орбиталь содержит неподелённую пару.
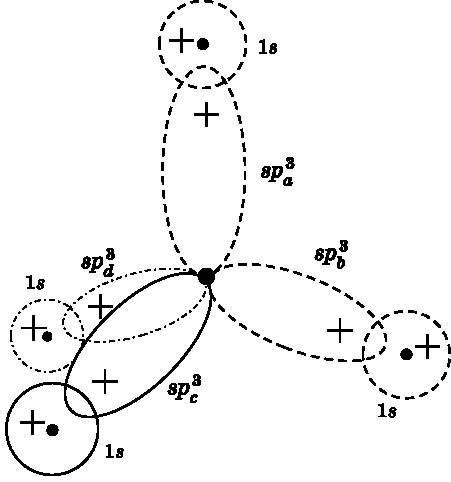
Рис. 14.8. Четыре sp 3 -гибридизированные атомные орбитали углерода и четыре 1s-орбитали водорода в молекуле метана, где атом углерода соединён с четырьмя атомами водорода. Штриховые орбитали лежат в плоскости страницы. Сплошная орбиталь выступает над этой плоскостью. Штрихпунктирная орбиталь лежит за плоскостью страницы. Показаны только положительные лепестки гибридных sp 3 -орбиталей. Четыре гибридные sp 3 -орбитали образуют правильный тетраэдр
Как уже говорилось, угол, образуемый связями H?N?H, немного меньше угла в правильном тетраэдре (109,5°), поскольку пространственное распределение неподелённой пары электронов несколько шире, чем у связывающей пары электронов N?H, и эта более широкая неподелённая пара подталкивает N?H-связи немного ближе друг к другу. Кислород в молекуле воды H2O имеет шесть валентных электронов. Четыре из них образуют две неподелённые пары, которые не участвуют в химической связи. Кислород использует две свои гибридные sp3-орбитали для образования связей с двумя атомами водорода. Две другие sp3-орбитали заняты неподелёнными парами. Эти две неподелённые пары приводят к тому, что угол HOH оказывается меньше, чем угол в правильном тетраэдре, равный 109,5°(см. 14.2).
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК