Правило 3 (правило Хунда): спины не спариваются, если это возможно без нарушения правил 1 и 2
Правило 3 называется правилом Хунда. Оно утверждает, что, заполняя орбитали с одинаковой энергией, электроны остаются по возможности неспаренными. На рис. 11.3 правило Хунда проиллюстрировано на примере 2p-орбиталей. Первый электрон, обозначенный на рисунке цифрой 1, занимает 2px-орбиталь. Этот выбор произволен, поскольку все три 2p-орбитали имеют одинаковую энергию. Согласно правилу Хунда, второй электрон займёт одну из двух других 2p-орбиталей, имеющих одинаковую энергию, так чтобы спины не спаривались. В нашем примере он попадает на 2py-орбиталь. Третий электрон должен заселиться на 2pz-орбиталь — это единственный способ соблюсти правило Хунда, а также правила 1 и 2. Наконец, четвёртый электрон спаривается с одним из остальных электронов. Как показано на рисунке, он занимает 2px-орбиталь. Его спин должен быть направлен вниз, чтобы соблюдался принцип Паули, правило 1.
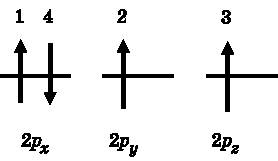
Рис. 11.3. Иллюстрация правила Хунда. При заселении 2p-орбиталей электрон 1 занимает 2p x -орбиталь, электрон 2 — 2p y , электрон 3 — 2p z . Все они имеют спин, направленный вверх. Электрон 4 обязан будет иметь спин, направленный вниз, чтобы спариться во избежание нарушения принципа Паули
Правило Хунда возникает потому, что оно даёт электронные конфигурации с наименьшей возможной энергией. При заселении двух электронов на две разные 2p-орбитали они размещаются в среднем дальше друг от друга, чем при заселении на одну и ту же орбиталь. Энергия уменьшается, поскольку удаление электронов друг от друга приводит к ослаблению их взаимного отталкивания. Таким образом, правило Хунда, по сути, требует помещать электроны по возможности на разные орбитали. Хотя факт уменьшения энергии при сохранении электронов неспаренными весьма важен, величина, на которую снижается энергия, незначительна. Поэтому лучше спарить электрон 4 на 2px-орбитали, чем разместить его неспаренным на более высокоэнергетической 3s-орбитали.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК