1. Алканы
Алканы (предельные углеводороды, парафины) – ациклические насыщенные углеводороды общей формулы СnH2n+2. В соответствии с общей формулой алканы образуют гомологический ряд.
Первые четыре представителя имеют полусистематические названия – метан (CH4), этан (С2Н6), пропан (С3Н8), бутан (С4Н10). Названия последующих членов ряда строятся из корня (греческие числительные) и суффикса -ан: пентан (С5Н12), гексан (С6Н14), гептан (С7Н16) и т. д.
Атомы углерода в алканах находятся в sp3-гибридном состоянии. Оси четырех sp3-орбиталей направлены к вершинам тетраэдра, валентные углы равны 109°28 .
Пространственное строение метана:
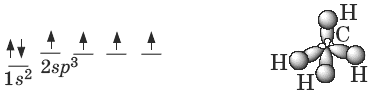
Энергия С—С связи Ес—с = 351 кДж/моль, длина С—С связи 0,154 нм.
Связь С—С в алканах является ковалентной неполярной. Связь С—Н – ковалентная слабополярная.
Для алканов, начиная с бутана, существуют структурные изомеры (изомеры строения), различающиеся порядком связывания между атомами углерода, с одинаковым качественным и количественным составом и молекулярной массой, но различающихся по физическим свойствам.

Способы получения алканов
1. СnH2n+2 ?400–700 °C? СpH2p+2 + СmH2m,
n = m + p.
Крекинг нефти (промышленный способ). Алканы также выделяют из природных источников (природный и попутный газы, нефть, каменный уголь).
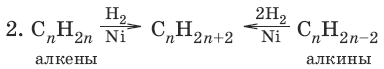
(гидрирование непредельных соединений)
3. nCO + (2n + 1)Н2 ? СnH2n+2 + nH2O (получение из синтез-газа (CO + Н2))
4. (реакция Вюрца)
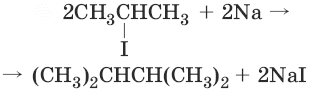
5. (реакция Дюма) CH3COONa + NaOH ?t? CH4 + Na2CO3
6. (реакция Кольбе)
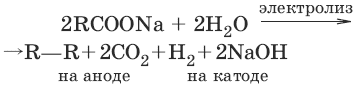
Химические свойства алканов
Алканы не способны к реакциям присоединения, т. к. в их молекулах все связи насыщены, для них характерны реакции радикального замещения, термического разложения, окисления, изомеризации.
1. (реакционная способность убывает в ряду: F2 > Cl2 > Br2 > (I2 не идет), R3C• > R2CH• > RCH2• > RCH3•)
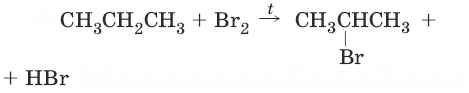
2. (реакция Коновалова)
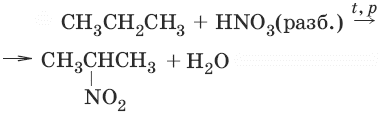
3. CnH2n+2 + SO2 + ?O2 ?h?? CnH2n+1SO3H – алкилсульфокислота
(сульфоокисление, условия реакции: облучение УФ)
4. CH4 ?1000 °C? С + 2Н2; 2CH4 ?t>1500 °C? С2Н2 + ЗН2 (разложение метана – пиролиз)
5. CH4 + 2Н2O ?Ni, 1300 °C? CO2 + 4Н2 (конверсия метана)
6. 2СnH2n+2 + (Зn+1)O2 ? 2nCO2 + (2n+2)Н2O (горение алканов)
7. 2н-С4Н10 + 5O2 ? 4CH3COOH + 2Н2O (окисление алканов в промышленности; получение уксусной кислоты)
8. н-С4Н10 ? изо-С4Н10 (изомеризация, катализатор AlCl3)
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК