6.8. Протолитическая теория кислот и оснований
Протолиз – процесс передачи протона.
Протолиты – кислоты и основания, отдающие и принимающие протоны.
Кислота – молекула или ион, способные отдавать протон. Каждой кислоте соответствует сопряженное с нею основание. Сила кислот характеризуется константой кислоты Кк.
Н2CO3 + Н2O ? Н3O+ + HCO3?
Кк = 4 ? 10-7
[Al(Н2O)6]3+ + Н2O ? [Al(Н2O)5OH]2+ + Н3O+
Кк = 9 ? 10-6
Основание – молекула или ион, способные принимать протон. Каждому основанию соответствует сопряженная с ним кислота. Сила оснований характеризуется константой основания К0.
NH3 ? Н2O (Н2O) ? NH4+ + OH?
К0= 1,8 ?10-5
Амфолиты – протолиты, способные к отдаче и к присоединению протона.
HCO3? + H2O ? Н3O+ + CO32-
HCO3? – кислота.
HCO3? + H2O ? Н2CO3 + OH?
HCO3? – основание.
Для воды: Н2O+ Н2O ? Н3O+ + OH?
K(H2O) = [Н3O+][OH?] = 10-14 и рН = – lg[H3O+].
Константы Кк и К0 для сопряженных кислот и оснований связаны между собой.
НА + Н2O ? Н3O+ + А?,
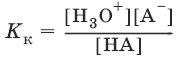
А? + Н2O ? НА + OH?,
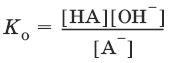
Отсюда
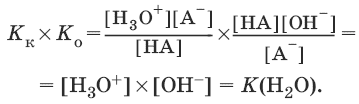
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК