6.7. Гидролиз солей
Гидролиз солей – взаимодействие ионов соли с водой с образованием слабого электролита.
Примеры уравнений реакций гидролиза.
I. Соль образована сильным основанием и слабой кислотой:
Na2CO3 + H2O ? NaHCO3 + NaOH
2Na+ + CO32- + H2O ? 2Na+ + HCO3? + OH?
CO32- + H2O ? HCO3? + OH?, pH > 7, щелочная среда.
По второй ступени гидролиз практически не идет.
II. Соль образована слабым основанием и сильной кислотой:
AlCl3 + H2O ? (AlOH)Cl2 + HCl
Al3+ + ЗCl? + H2O ? AlOH2+ + 2Cl? + Н+ + Cl?
Al3+ + H2O ? AlOH2+ + Н+, рН < 7.
По второй ступени гидролиз идет меньше, а по третьей ступени практически не идет.
III. Соль образована сильным основанием и сильной кислотой:
KNO3 + H2O ?
К+ + NO3? + Н2O ? нет гидролиза, рН ? 7.
IV. Соль образована слабым основанием и слабой кислотой:
CH3COONH4 + H2O ? CH3COOH + NH4OH
CH3COO? + NH4+ + H2O ? CH3COOH + NH4OH, рН = 7.
В ряде случаев, когда соль образована очень слабыми основаниями и кислотами, идет полный гидролиз. В таблице растворимости у таких солей символ – «разлагаются водой»:
Al2S3 + 6Н2O = 2Al(OH)3? + 3H2S?
Возможность полного гидролиза следует учитывать в обменных реакциях:
Al2(SO4)3 + 3Na2CO3 + 3H2O = 2Al(OH)3? + 3Na2SO4 + 3CO2?
Степень гидролиза h – отношение концентрации гидролизованных молекул к общей концентрации растворенных молекул.
Для солей, образованных сильным основанием и слабой кислотой:
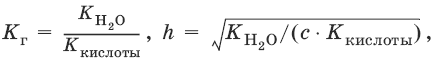
[OH?] = ch, рOH = – lg[OH?], рН = 14 – рOH.
Из выражения следует, что степень гидролиза h (т. е. гидролиз) увеличивается:
а) с увеличением температуры, так как увеличивается K(H2O);
б) с уменьшением диссоциации кислоты, образующей соль: чем слабее кислота, тем больше гидролиз;
в) с разбавлением: чем меньше с, тем больше гидролиз.
Для солей, образованных слабым основанием и сильной кислотой
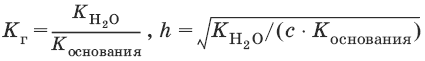
[Н+] = ch, рН = – lg[H+].
Для солей, образованных слабым основанием и слабой кислотой
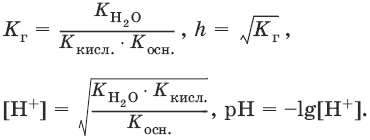
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК