1.3. Второе начало термодинамики. Энтропия
1) Теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому.
2) Невозможен процесс, единственным результатом которого является превращение теплоты в работу.
3) Существует некоторая функция состояния системы, названная энтропией, изменение которой следующим образом связано с поглощаемой теплотой и температурой системы:
в неравновесном процессе
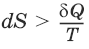
в равновесном процессе
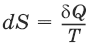
S – энтропия, Дж/град,
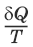
– приведенная теплота.
Статистическая интерпретация энтропии
Каждому состоянию системы приписывается термодинамическая вероятность (определяемая как число микросостояний, составляющих данное макросостояние системы), тем большая, чем более неупорядоченным или неопределенным является это состояние. Энтропия – функция состояния, описывающая степень неупорядоченности системы.
S = klnW – формула Больцмана.
Система стремится самопроизвольно перейти в состояние с максимальной термодинамической вероятностью.
Расчет абсолютной энтропии
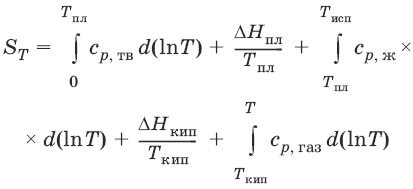
Изменение энтропии в ходе химического процесса определяется только видом и состоянием исходных веществ и продуктов реакции и не зависит от пути реакции:
?S = ?(?iSi)прод – ?(?iSi)исх
Величины абсолютной энтропии в стандартных условиях приведены в справочной литературе.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК