9.1. Хром и его соединения
Хром представляет собой ковкий тягучий металл серо-стального цвета. Электронная формула атома хрома 1s22s22p63s23p63d54s1.
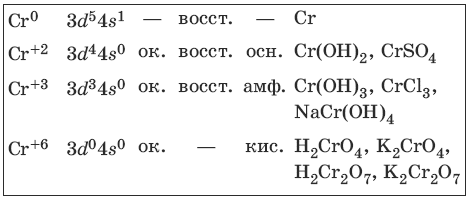
Характерные степени окисления хрома, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Получение и свойства хрома
FeO • Cr2O3 + 4CO ?t? Fe + 2Cr + 4CO2 (Fe + 2Cr) – феррохром
Сr2O3 + 2Al ?t? 2Сr + Al2O3 – метод алюминотермии
Хром пассивируется на холоду концентрированными азотной и серной кислотами.
Сr + 2HCl = СrCl2 + Н2
СrCl2 + 2NaOH = Cr(OH)2? + 2NaCl
Свойства соединений хрома (+2) и хрома (+3)
Гидроксид хрома(II) сразу окисляется кислородом воздуха.
4Сr(OH)2 + O2 + 2Н2O = 4Сr(OH)3
СrCl3 + 3NaOH = Cr(OH)3? + 3NaCl
Cr(OH)3? + 3Na(OH) = Na3[Cr(OH)6]
Cr2O3 + 2NaOH ?t? 2NaCrO2 + H2O
Cr(OH)3? + 3HCl = CrCl3 + 3H2O
2Cr(OH)3 ?t? Cr2O3 + 3H2O
2CrCl3 + 3Cl2 + 16KOH = 2K2CrO4 + 12KCl + 8H2O
2Na3Cr(OH)6 + 3Br2 + 4NaOH = 2Na2CrO4 + 6NaBr + 8H2O
Свойства соединений хрома (+6)
CrO3 + Н2O = H2CrO4
2CrO3 + H2O = H2Cr2O7
Желтый раствор хромата калия устойчив в щелочной среде, оранжевый раствор дихромата калия – в кислой среде.
К2Сr2O7 + 2KOH = 2К2СrO4 + Н2O
2K2CrO4 + H2SO4 = K2SO4 + K2Cr2O7 + Н2O
(NH4)2Cr2O7 ?t? Cr2O3 + N2 + 4Н2O
Дихромат калия – окислитель в кислой среде.
К2Сr2O7 + 4H2SO4 + 3Na2SO3 = Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4H2O
K2Cr2O7 + 4H2SO4 + 3NaNO2 = Cr2(SO4)3 + 3NaNO3 + K2SO4 + 4H2O
K2Cr2O7 + 7H2SO4 + 6KI = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
K2Cr2O7 + 7H2SO4 + 6FeSO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК