3.4. Коллигативные свойства растворов электролитов:
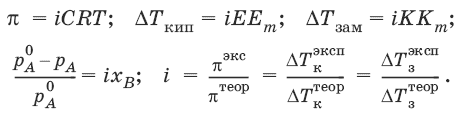
Теория электролитической диссоциации Аррениуса
1. Электролиты в растворах распадаются на ионы – диссоциируют.
2. Диссоциация является обратимым равновесным процессом.
3. Силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т. е. растворы являются идеальными).
Диссоциация электролитов в растворе происходит под действием полярных молекул растворителя; наличие ионов в растворе предопределяет его электропроводность.
По величине степени диссоциации электролиты подразделяются на три группы: сильные (? ? 0,7), средней силы (0,3 < ? < 0,7) и слабые (? ? 0,3).
Слабые электролиты. Константа диссоциации
Для некоторого электролита, распадающегося в растворе на ионы в соответствии с уравнением:
АаВb ? аАx- + bВy+
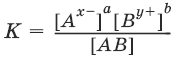
Для бинарного электролита:
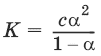
Для разбавленных растворов можно считать, что (1 – ?) = 1 и К ? ?2С.
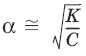
– закон разбавления Оствальда: степень диссоциации слабого электролита возрастает с разбавлением раствора.
Активность растворенного вещества – эмпирическая величина, заменяющая концентрацию, – активность (эффективная концентрация) а, связанная с концентрацией через коэффициент активности f, который является мерой отклонения свойств реального раствора от идеального:
а = fC; а+ = f+С+; а_ = f_C_.
Для бинарного электролита:
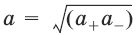
– средняя активность электролита;

– средний коэффициент активности.
Предельный закон Дебая-Хюккеля для бинарного электролита: lg f = -0,51z 2I ?, где z – заряд иона, для которого рассчитывается коэффициент активности;
I – ионная сила раствора I = 0,5?(Сiri2).
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК