1.3. Кислоты
Кислоты – сложные вещества, состоящие из атомов водорода и кислотного остатка; кислоты – электролиты, образующие при диссоциации в качестве катионов только катионы водорода.
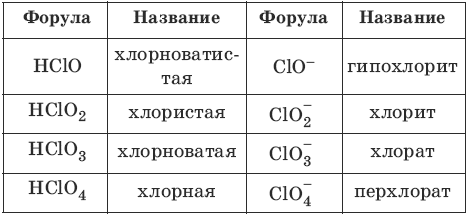
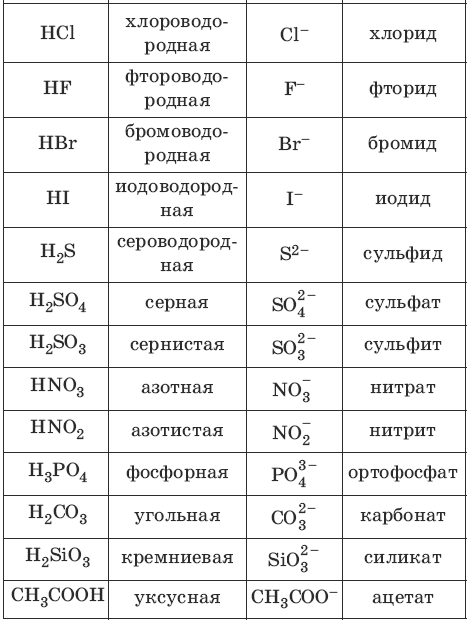
Номенклатура кислот и кислотных остатков:
Классификация кислот:
– одноосновные HCl
– двухосновные H2S
– трехосновные Н3PO4
– кислородсодержащие HNO3
– бескислородные HCl
Получение кислот
CO2 + Н2O = Н2CO3 (кроме SiO2)
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3?
H2 + Cl2 = 2HCl
Химические свойства кислот
HCl ? H+ + CI? (? =1) (лакмус – красный)
CH3COOH ? CH3COO? + H+ (? << 1)
Fe + 2HCl = FeCl2 + H2 (металл в ряду напряжений до Н)
Cu + HCl ? (не идет, металл в ряду напряжений после Н)
2HCl + CuO = CuCl2 + Н2O
2HCl + Cu(OH)2 = CuCl2 + 2Н2O
2HCl + ZnO = ZnCl2 + Н2O
3HCl + Al(OH)3 = AlCl3 + 3Н2O
2HCl + Na2CO3 = 2NaCl + H2O + CO2? (выделяется газ)
HCl + AgNO3 = AgCl? + HNO3 (образуется осадок)
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК