5. Окислительно-восстановительные реакции
Окислительно-восстановите льные реакции – реакции, которые идут с изменением степеней окисления элементов.
Окисление – процесс отдачи электронов.
Восстановление – процесс присоединения электронов.
Окислитель – атом, молекула или ион, который принимает электроны.
Восстановитель – атом, молекула или ион, который отдает электроны.
Окислители, принимая электроны, переходят в восстановленную форму:
F2 [ок. ] + 2? ? 2F? [восст.].
Восстановители, отдавая электроны, переходят в окисленную форму:
Na0 [восст. ] – 1? ? Na+ [ок.].
Равновесие между окисленной и восстановленной формами характеризуется с помощью уравнения Нернста для окислительно-восстановительного потенциала:
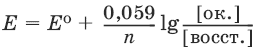
где Е0 – стандартное значение окислительно-восстановительного потенциала; n – число переданных электронов; [восст. ] и [ок. ] – молярные концентрации соединения в восстановленной и окисленной формах соответственно.
Величины стандартных электродных потенциалов Е0 приведены в таблицах и характеризуют окислительные и восстановительные свойства соединений: чем поло-жительнее величина Е0, тем сильнее окислительные свойства, и чем отрицательнее значение Е0, тем сильнее восстановительные свойства.
Например, для F2 + 2? ? 2F?Е0 = 2,87 вольт, а для Na+ + 1? ? Na0Е0 = -2,71 вольт (процесс всегда записывается для реакций восстановления).
Окислительно-восстановительная реакция представляет собой совокупность двух полуреакций, окисления и восстановления, и характеризуется электродвижущей силой (э.д.с.) ?Е0: ?Е0 = ?Е0ок – ?Е0восст, где Е0ок и ?Е0восст – стандартные потенциалы окислителя и восстановителя для данной реакции.
Э.д.с. реакции ?Е0 связана с изменением свободной энергии Гиббса ?G и константой равновесия реакции К:
?G = – nF?Е0 или ?Е = (RT/nF)lnK.
Э.д.с. реакции при нестандартных концентрациях ?Е равна: ?Е = ?Е0 – (RT/nF) ? IgK или ?Е = ?Е0 – (0,059/n)lgK.
В случае равновесия ?G = 0 и ?Е = 0, откуда ?Е = (0,059/n)lgK и К = 10n?E/0,059.
Для самопроизвольного протекания реакции должны выполняться соотношения: ?G < 0 или К >> 1, которым соответствует условие ?Е0 > 0. Поэтому для определения возможности протекания данной окислительно-восстановительной реакции необходимо вычислить значение ?Е0. Если ?Е0 > 0, реакция идет. Если ?Е0 < 0, реакция не идет.
Химические источники тока
Гальванические элементы – устройства, преобразующие энергию химической реакции в электрическую энергию.
Гальванический элемент Даниэля состоит из цинкового и медного электродов, погруженных в растворы ZnSO4 и CuSO4 соответственно. Растворы электролитов сообщаются через пористую перегородку. При этом на цинковом электроде идет окисление: Zn ? Zn2+ + 2?, а на медном электроде – восстановление: Cu2+ + 2? ? Cu. В целом идет реакция: Zn + CuSO4 = ZnSO4 + Cu.
Анод – электрод, на котором идет окисление. Катод – электрод, на котором идет восстановление. В гальванических элементах анод заряжен отрицательно, а катод – положительно. На схемах элементов металл и раствор отделены вертикальной чертой, а два раствора – двойной вертикальной чертой.
Так, для реакции Zn + CuSO4 = ZnSO4 + Cu схемой гальванического элемента является запись: (-)Zn | ZnSO4 || CuSO4 | Cu(+).
Электродвижущая сила (э.д.с.) реакции равна ?Е0 = Е0ок – Е0восст = Е0(Cu2+/Cu) – Е0(Zn2+/Zn) = 0,34 – (-0,76) = 1,10 В. Из-за потерь напряжение, создаваемое элементом, будет несколько меньше, чем ?Е0. Если концентрации растворов отличаются от стандартных, равных 1 моль/л, то Е0ок и Е0восст вычисляются по уравнению Нернста, а затем вычисляется э.д.с. соответствующего гальванического элемента.
Сухой элемент состоит их цинкового корпуса, пасты NH4Cl с крахмалом или мукой, смеси MnO2 с графитом и графитового электрода. В ходе его работы идет реакция: Zn + 2NH4Cl + 2MnO2 = [Zn(NH3)2]Cl + 2MnOOH.
Схема элемента: (-)Zn | NH4Cl | MnO2, C(+). Э.д.с. элемента – 1,5 В.
Аккумуляторы. Свинцовый аккумулятор представляет собой две свинцовые пластины, погруженные в 30%-ный раствор серной кислоты и покрытые слоем нерастворимого PbSO4. При заряде аккумулятора на электродах идут процессы:
PbSO4(тв) + 2? ? Рb(тв) + SO42-
PbSO4(тв) + 2H2O ? РbO2(тв) + 4H+ + SO42- + 2?
При разряде аккумулятора на электродах идут процессы:
РЬ(тв) + SO42- ? PbSO4(тв) + 2?
РbO2(тв) + 4H+ + SO42- + 2? ? PbSO4(тв) + 2Н2O
Суммарную реакцию можно записать в виде:
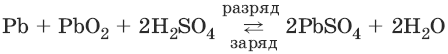
Для работы аккумулятор нуждается в регулярной зарядке и контроле концентрации серной кислоты, которая может несколько уменьшаться при работе аккумулятора.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК