4.3. Метод комплексонометрии
Комплексонометрия – титриметриче-ский метод анализа, основанный на реакциях комплексообразования определяемых ионов металлов с некоторыми органическими веществами, в частности с комплексонами.
Комплексоны – аминополикарбоновые кислоты и их производные (соли).
В титриметрическом анализе широко используется один из представителей класса комплексонов – динатриевая соль этилендиаминтетрауксусной кислоты (Ма2Н2ЭДТА). Этот комплексон часто называют также трилоном Б или комплексном III:
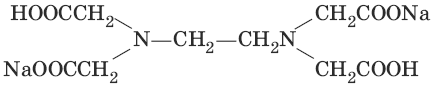
или [Na2H2ЭДTA]
Трилон Б со многими катионами металлов образует прочные, растворимые в воде внутрикомплексные соединения (хелаты). При образовании хелата катионы металла замещают два атома водорода в карбоксильных группах трилона Б и образуют координационные связи с участием атомов азота аминогрупп.
Уравнение реакции: Ме2+ + Н2ЭДТА2- ? [МеЭДТА]2- + 2Н+
Основные титранты (рабочие растворы): трилон Б, MgSO4, CaCl2
Установочные вещества (или первичные стандарты): MgSO4, CaCl2
Индикаторы: металлохромные индикаторы, эриохром черный Т
При рН = 7-11 анион этого индикатора (HInd2-) имеет синюю окраску. С катионами металлов (Са2+, Mg2+, Zn2+ и др.) в слабощелочном растворе в присутствии аммиачного буфера (рН = 8-10) он образует комплексные соединения винно-красного цвета по схеме:
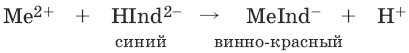
При титровании исследуемого раствора трилоном Б:
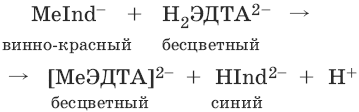
Константы нестойкости комплексов равны соответственно:
Kн([CaInd]?) = 3,9 • 10-6
Kн([СаЭДТА]2-) = 2,7 • 10-11
Kн([MgInd]?) = 1,0 •1 0-7
Kн([MgЭДTA]2-) = 2,0 • 10-9
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК