7. Константа растворимости. Растворимость
В системе, состоящей из раствора и осадка, идут два процесса – растворение осадка и осаждение. Равенство скоростей этих двух процессов является условием равновесия.
Насыщенный раствор – раствор, который находится в равновесии с осадком.
Закон действия масс в применении к равновесию между осадком и раствором дает:
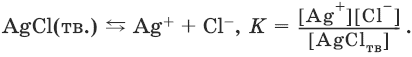
Поскольку [AgClтв] = const,
К • [AgClтв] = Ks(AgCl) = [Ag+] • [Cl?].
В общем виде имеем:
АmBn(тв.) ? mA+n + nB-m
Ks(AmBn) = [А+n]m • [В-m]n.
Константа растворимости Ks (или произведение растворимости ПР) – произведение концентраций ионов в насыщенном растворе малорастворимого электролита – есть величина постоянная и зависит лишь от температуры.
Растворимость малорастворимого вещества s может быть выражена в молях на литр. В зависимости от величины s вещества могут быть разделены на малорастворимые – s < 10-4 моль/л, среднерастворимые – 10-4 моль/л ? s ? 10-2 моль/л и хорошо растворимые s >10-2 моль/л.
Растворимость соединений связана с их произведением растворимости.
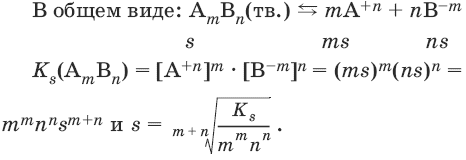
Условие осаждения и растворения осадка
В случае AgCl: AgCl ? Ag+ + Cl?
Ks = [Ag+] • [CI?]:
а) условие равновесия между осадком и раствором: [Ag+] • [Cl?] = Ks.
б) условие осаждения: [Ag+] • [Cl?] > Ks; в ходе осаждения концентрации ионов уменьшаются до установления равновесия;
в) условие растворения осадка или существования насыщенного раствора: [Ag+] • [Cl?] < Ks; в ходе растворения осадка концентрация ионов увеличивается до установления равновесия.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК