1.2. Применение первого начала термодинамики к гомогенным однокомпонентным закрытым системам
Изохорный процесс (V = const; ?V = 0)
В простейшем случае – полезная работа не совершается.
dU = ?Q + ?W = ?Q – pdV
dU = ?Qv = CVdT = nCVdT
Все количество теплоты, полученное системой, идет на изменение внутренней энергии.
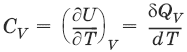
– теплоемкость при постоянном объеме, т. е. количество теплоты, необходимое для повышения температуры системы на один градус при постоянном объеме. [СV] = Дж/град.
?V – мольная теплоемкость при постоянном объеме, Дж/(моль ? град). Для идеальных газов:
?V = 2/3R – одноатомный газ;
?V = 5/2R – двухатомный газ.
Изобарный процесс (Р = const)
dU = ?Q + ?W = ?Q – pdV
?Qp = dU + pdV = d(U + pV) = dH
H = U + pV – энтальпия – функция состояния системы.
?Н = ?(?iUi)прод – ?(?iUi)исх
?Qp = dU + pdV =dH = CpdT – тепловой эффект изобарного процесса равен изменению энтальпии системы.
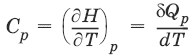
– теплоемкость при постоянном давлении. [С] = Дж/град.
?р – мольная теплоемкость при постоянном давлении, Дж/(моль ? град).
Для идеальных газов: ?р = ?V + R; ?р, ?V = [Дж/(моль • К)].
Тепловой эффект (теплота) химической реакции – количество теплоты, выделившейся либо поглотившейся в ходе реакции при постоянной температуре.
Qv = ?UV
Qp = ?Up
Зависимость теплового эффекта реакции от температуры. Закон Кирхгоффа
Температурный коэффициент теплового эффекта химической реакции равен изменению теплоемкости системы в ходе реакции.
Закон Кирхгоффа:
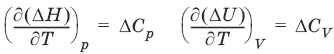
Для химического процесса изменение теплоемкости задается изменением состава системы:
?Ср = ?(?iCp,i)прод – ?(?iCp,i)исх или ?CV = ?(?iCV,i)прод – ?(?iCV,i)исх
Интегральная форма закона Кирхгоффа:
?НТ2 = ?НТ1 + ?Ср(Т2 – T1) или ?UT2 = ?UTi + ?СV(Т2 – T1)
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК