§ 4. Молекула бензола
Для изображения сложных органических молекул химики изобрели изящные диаграммы. Мы хотим теперь поговорить об одной из самых интересных молекул — о молекуле бензола, диаграмма которой приведена на фиг. 8.6.

Фиг. 8.6. Молекула бензола С6Н6.
В нее входят по шести весьма симметрично расположенных атомов углерода и водорода. Каждая черточка на диаграмме представляет пару электронов с противоположными спинами, пляшущих танец ковалентной связи. Каждый атом водорода вводит в игру по одному электрону, а каждый атом углерода — по четыре, образуя в общей сложности систему из 30 участвующих в игре электронов. (В углероде ближе к ядру есть еще два электрона, образующих первую, или К, оболочку. Они не показаны, поскольку их связь столь тесна, что сколько-нибудь заметной важности для ковалентной связи они не представляют.) Итак, каждая черточка на рисунке представляет связь, или пару электронов, а двойные связи означают, что между чередующимися парами атомов углерода имеются по две пары электронов.
С молекулой бензола связана одна загадка. Можно подсчитать, какая энергия должна потребоваться на образование этого химического соединения, потому что химики измерили энергии различных соединений, включающих части кольца; к примеру, изучая этилен, они узнали энергию двойной связи и т. д. Поэтому мы можем подсчитать полную энергию, которую должна была бы иметь молекула бензола. Однако истинная энергия бензольного кольца намного меньше, чем получается при таком подсчете: кольцо связано куда крепче, чем полагается обычной системе «ненасыщенных двойных связей». Как правило, система двойных связей, не образующая подобного кольца, весьма легко поддается химическим атакам: ее энергия сравнительно высока, и, добавляя лишние атомы водорода, двойные связи удается легко разрывать. Не то у бензола — кольцо его почти нерушимо: сломать его нелегко. Иными словами, энергия бензола намного ниже, чем дает подсчет по картине двойных связей.
Имеется еще и другая загадка. Пусть мы заменили два смежных водорода атомами брома, образуя орто-дибромбензол. Это можно сделать двумя путями. Атомы брома могут быть на противоположных концах двойной связи (фиг. 8.7, а) или могут быть на противоположных концах одинарной связи (фиг. 8.7, б).

Фиг. 8.7. Две возможности для орто-дибромбензола. Два атома брома могут разделяться либо одиночной связью, либо двойной.
Можно было бы подумать, что должны существовать две разные формы орто-дибромбензола, но это не так. Есть только одно такое вещество[26].
Теперь мы собираемся разрешить эти загадки, и вы, может быть, уже догадались как: конечно, дело в том, что «основное состояние» бензольного кольца на самом деле является системой с двумя состояниями. Можно представить себе, что связи в бензоле могут быть расположены двояким образом, как показано на фиг. 8.8.
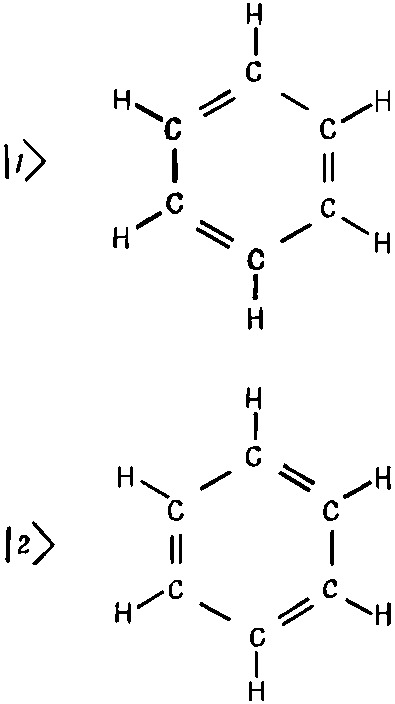
Фиг. 8.8. Совокупность базисных состояний для молекулы бензола.
Вы скажете: «Но ведь это одно и то же; у них должна быть одинаковая энергия». Конечно, должна быть. Именно поэтому их и надо анализировать как систему с двумя состояниями. Каждое состояние представляет другую конфигурацию всей совокупности электронов, и существует некоторая амплитуда А того, что все переплетение переключится с одного расположения на другое, есть какой-то шанс, что электроны смогут сменить фигуру в танце.
Как мы видели, эта вероятность переброса приводит к смешанному состоянию, энергия которого ниже, чем получилось бы, если бы мы рассчитали каждую из схем, представленных на фиг. 8.8, по отдельности. Вместо этого существуют два стационарных состояния: одно с энергией выше, другое — ниже ожидаемого значения. Значит, в действительности истинное нормальное состояние бензола (с наинизшей энергией) не есть какая-либо из возможностей, представленных на фиг. 8.8,а обладает амплитудой 1/?2 пребывания в каждом из нарисованных состояний. Это единственное состояние, которое и стоит принимать в расчет в химии бензола при нормальных температурах. Кстати, существует и верхнее состояние; мы вправе так говорить, потому что бензол обладает сильным поглощением света в ультрафиолетовой области с частотой ?=(ЕI -EII)/?. Вспомните, что в аммиаке, где прыгающим вверх и вниз объектом являлась тройка протонов, расстояние между энергиями приходилось на микроволновую область. В бензоле таким объектом являются электроны, и, поскольку они намного легче, им и перескакивать туда-сюда тоже намного легче, отчего и коэффициент А становится куда больше. В итоге разница энергий намного больше — около 1,5 эв, а это энергия ультрафиолетового фотона[27].
Что же происходит, когда мы присоединяем бром? Тогда опять возникают две возможности с двумя разными электронными конфигурациями, показанные на фиг. 8.7. Отличие их в том, что те два базисных состояния, из которых мы исходим, обладают теперь слегка различными энергиями. В стационарное состояние с наинизшей энергией по-прежнему войдет линейная комбинация двух состояний, но с неравными амплитудами. Для состояния |1> амплитуда может стать равной, скажем, ?2/3, для состояния |2> она будет ?1/3; чтобы знать коэффициенты точно, нужна добавочная информация, но, во всяком случае, если уж энергии H11 и H22 не равны друг другу, то и амплитуды С1 и С2 не могут быть равны между собой. Это, естественно, означает, что одна из двух изображенных на рисунке возможностей более вероятна, чем другая, но все же электроны достаточно подвижны, чтобы и та, и другая обладали какой-то конечной амплитудой. У другого стационарного состояния амплитуды другие (скажем, ?1/3 и -?2/3), но оно лежит при более высокой энергии. Есть только одно наинизшее состояние, а не два, как можно было бы подумать, пользуясь наивной теорией закрепленных химических связей.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК