§ 6. Периодическая таблица
Теперь мы хотели бы применить теорию атома водорода к объяснению химической периодической таблицы элементов. В атоме элемента с атомным номером Z имеется Z электронов, которые удерживаются электрическим притяжением ядра, но при этом взаимно отталкиваются друг от друга. Чтобы получить точное решение, пришлось бы решить уравнение Шредингера для Z электронов в кулоновом поле. Для гелия уравнение имеет вид
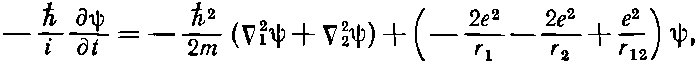
где ?21 — лапласиан, который действует на r1, координату первого электрона; ?22 действует на r2, а r12=|r1-r2|. (Мы опять пренебрегаем спинами электронов.) Чтобы найти стационарные состояния и уровни энергии, следовало бы отыскать решения вида
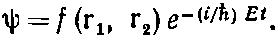
Геометрическая зависимость заключена в f — функции шести переменных — одновременных положений двух электронов. Аналитического решения никто не знает, хотя решения для низших энергетических состояний и были найдены численными методами.
Когда электронов 3, 4 или 5, безнадежно пытаться получить точные решения. Поэтому было бы опрометчиво утверждать, что квантовая механика до конца объяснила периодическую таблицу. Но все же можно сказать, что даже с помощью довольно сомнительных приближений (и кое-какой последующей отделки) удается, по крайней мере качественно, понять многие химические свойства, проявляющиеся в периодической таблице.
Химические свойства атомов определяются в первую очередь их низшими энергетическими состояниями. Для отыскания этих состояний и их энергий мы воспользуемся следующей приближенной теорией. Во-первых, пренебрежем спином электрона, разве только что принцип запрета будет принят нами во внимание и мы будем считать, что каждое частное электронное состояние может быть занято только одним электроном. Это означает, что на одной орбите не может оказаться больше двух электронов — один со спином, направленным вверх, другой — вниз. Затем мы в первом приближении пренебрежем деталями взаимодействия электронов и будем считать, что каждый электрон движется в центральном поле, образуемом полями ядра и всех прочих электронов. Про неон, у которого 10 электронов, мы скажем, например, что каждый электрон в атоме неона испытывает влияние среднего потенциала ядра и оставшейся девятки электронов. Мы вообразим далее, что в уравнение Шредингера для каждого электрона мы подставляем V(r) — то же поле 1/r, но только видоизмененное за счет сферически симметричной плотности заряда, возникшей от остальных электронов.
В такой модели каждый электрон ведет себя как независимая частица. Угловые зависимости его волновой функции будут попросту такими же, какие были у атома водорода. Это будут те же s-состояния, р-состояния и т. п., и у них будут различные значения m. Раз V(r) больше не следует закону 1/r, то радиальная часть волновых функций слегка перекраивается, но качественно останется прежней, так что по-прежнему будет существовать радиальное квантовое число n. Энергии состояний тоже станут немного иными.
Н
Что же при таких представлениях у нас получится с водородом? У основного состояния водорода l=m=0 и n=1; мы говорим, что у него электронная конфигурация 1s. Энергия равна -13,6 эв. Это значит, что для отрыва электрона от атома нужно 13,6 эв энергии. Ее называют «энергией ионизации», W1. Большая энергия ионизации означает, что оторвать электрон трудно, но водород может отнять электрон у другого атома, а потому он химически активен.
Не
Теперь обратимся к гелию. Оба электрона в гелии могут находиться в одном и том же нижнем состоянии (только у одного спин направлен вверх, у другого — вниз). В своем наинизшем состоянии электрон движется в поле с потенциалом, который при малых r походит на кулонов потенциал с Z=2, а при больших r — на кулонов потенциал с Z=1. В результате возникает «водородоподобное» 1s-состояние с несколько более низкой энергией. Оба электрона занимают одни и те же 1s-состояния (l=0, m=0). Наблюдаемая энергия ионизации (требуемая на отрыв одного электрона) равна 24,6 эв. Поскольку теперь «оболочка» 1s заполнена (больше двух электронов в нее не втиснешь), то практически не возникает тенденции уводить у других атомов электроны. Гелий химически инертен.
Li
Ядро лития имеет заряд 3. Состояния электрона опять будут водородоподобны, и тройка электронов займет три нижних уровня энергии. Два попадут в состояния 1s, а третий пойдет в состояние n=2. Но вот с l=0 или с l=1? В водороде у этих состояний энергия одна и та же, в других же атомах это не так, и вот по какой причине. Вспомним, что у 2s-состояния есть некоторая амплитуда того, что оно окажется вблизи ядра, а у 2р такой амплитуды нет. Это означает, что 2s-электрон как-то ощутит тройной электрический заряд ядра Li, а 2р-электрон останется там, где поле выглядит как кулоново поле единичного заряда. Добавочное притяжение понизит энергию 2s-состояния по сравнению с энергией 2р-состояния. Уровни энергии примерно окажутся такими, как показано на фиг. 17.8 (сравните с соответствующей диаграммой на фиг. 17.7 для водорода).
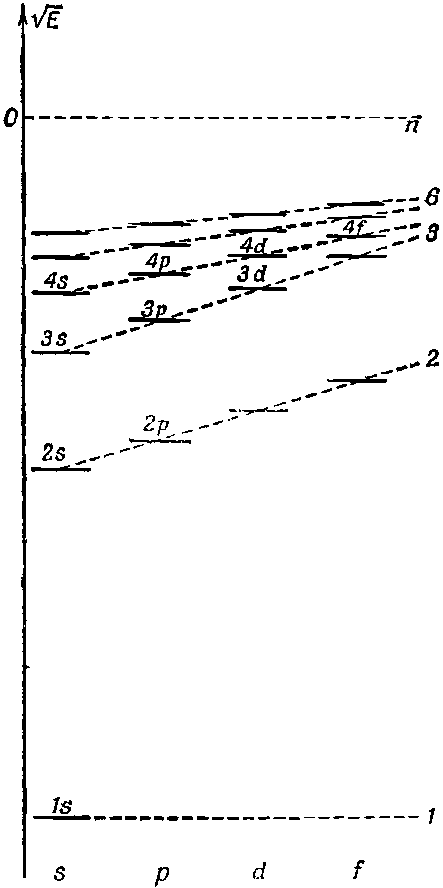
Фиг. 17.8. Схематическая диаграмма уровней энергии атомного электрона в присутствии других электронов. Масштаб иной, нежели на фиг. 17.7.
Значит, в атоме лития два электрона будут в 1s-состояниях, а один — в 2s-состоянии. Поскольку электрон в 2s-состоянии обладает более высокой энергией, чем электрон в 1s-состоянии, то его сравнительно легко удалить. Ионизационная энергия лития всего 5,4 эв, и он весьма активен химически.
Так постепенно перед вами развертывается вся картина; в табл. 17.2 мы привели список первых 36 элементов, отметив состояния, занимаемые электронами в основном состоянии каждого атома. Таблица дает энергию ионизации для наиболее слабо связанного электрона и количество электронов, занимающих каждую «оболочку», т. е. состояние с одним и тем же n.
Таблица 17.2. ЭЛЕКТРОННЫЕ КОНФИГУРАЦИИ ПЕРВЫХ 36 ЭЛЕМЕНТОВ (число электронов в разных состояниях)

Поскольку разные l-состояния обладают разными энергиями, то каждое значение l отвечает некоторой подоболочке из 2(2l+1) возможных состояний (с различными m и различными направлениями спина). У всех у них энергия одинакова с точностью до некоторых слабых эффектов, которыми мы пренебрежем.
Be
Бериллий похож на литий, только у него в 2s-состоянии находятся два электрона, а в заполненной 1s-оболочке тоже два.
От B до Ne
У бора 5 электронов. Пятый должен уйти в 2p-состояние. Всего бывает 2x3=6 разных 2p-состояний, поэтому можно продолжать добавлять по электрону, пока не дойдем до 8. Так мы доберемся до неона. Добавляя эти электроны, мы увеличиваем также Z, поэтому все электронное распределение все теснее и теснее стягивается к ядру и энергия 2p-состояний все снижается и снижается. К тому времени, когда мы достигнем неона, энергия ионизации возрастет до 21,6 эв. Неон легко своего электрона не отдает. У него к тому же больше нет пустых мест на орбите, которые можно заполнить, так что и чужие электроны ему не нужны. Стало быть, неон химически инертен. У фтора есть пустое место, попав на которое, электрон может оказаться в состоянии с низкой энергией, поэтому в химических реакциях фтор очень активен.
От Na до Ar
В натрии одиннадцатый электрон вынужден начать новую оболочку, переходя в 3s-состояние. Уровень энергии этого состояния намного выше; энергия ионизации резко спадает; натрий химически очень активен. От натрия до аргона s- и p-состояния с n=3 заполняются в той же последовательности, как от лития до неона. Угловые конфигурации электронов во внешней незаполненной оболочке идут в той же последовательности, и прогрессирующий рост энергии ионизации тоже весьма схож с тем, что было раньше. Вы теперь понимаете, почему химические свойства с ростом атомного числа повторяются. Химическое действие магния очень похоже на бериллий, кремния — на углерод, хлора — на фтор. Аргон, подобно неону, инертен.
Быть может, вы уже обратили внимание на то, что в последовательности энергий ионизации от лития до неона есть небольшая особенность, и такая же особенность наблюдается между натрием и аргоном. Последний электрон прикреплен к атому кислорода чуть слабее, чем можно было ожидать. Тем же самым отличается сера. Отчего бы это? Это можно понять, если чуть внимательнее вдуматься в эффекты взаимодействия между электронами. Подумаем о том, что бывает, когда мы помещаем в атом бора первый 2p-электрон. Он имеет шесть возможностей — три возможных р-состояния, в каждом по два спина. Представим, что электрон со спином вверх попадает в состояние с m=0, которое мы также будем называть «z»-состоянием, потому что оно облегает ось z. Ну, а что произойдет в углероде? Теперь уже 2p-электронов два. Если один из них попал в «z»-состояние, то куда попадет второй? Ниже всего его энергия будет тогда, когда он расположится подальше от первого электрона. Этого можно достичь, попав, скажем, в «x»-состояние 2p-оболочки. (Это состояние, как вы помните,— просто линейная комбинация состояний с m=+1 и с m=-1.) Дальше, когда мы перейдем к азоту, то у тройки 2p-электронов наименьшая энергия взаимного отталкивания будет тогда, когда один из них попадет в «x»-конфигурацию, другой — в «у», третий — в «z». Весь этот хоровод, однако, для кислорода не проходит. Четвертому электрону уже ничего не остается, как попасть в одно из заполненных состояний, держа при этом спин вниз. Тот электрон, который уже находится в этом состоянии, начнет его сильно отталкивать, так что его энергия не будет такой низкой, какой она была бы в противном случае, поэтому его легче будет удалить. Этим и объясняется разрыв в последовательности энергий связи, который появляется между азотом и кислородом, и между фосфором и серой.
От К до Zn
Можно было бы подумать, что за аргоном новые электроны начнут заполнять состояние 3d. Но нет! Как мы уже говорили (и иллюстрировали фиг. 17.7), состояния с высшими моментами сдвинуты по энергии вверх. К моменту, когда мы подошли к 3d-состояниям, они по энергии оказываются задвинутыми немножко выше энергии 4s-состояния. Поэтому в калии последний электрон попадет в 4s-состояние. После этого в кальции оболочка заполнится (двумя электронами), а 3d-состояния начнут заполняться у скандия, титана и ванадия.
Энергии 3р- и 4s-состояний так близки друг к другу, что малозаметные эффекты легко сдвигают равновесие в ту или иную сторону. К моменту, когда придет время поместить в Зd-состояния четыре электрона, их отталкивание так подымет энергию 4s-состояния, что она станет чуть выше энергии Зd-состояния, поэтому один электрон из s уходит в d. И для хрома не получается ожидавшаяся комбинация 4, 2, а вместо этого выступает комбинация 5, 1. Новый электрон, добавляемый, чтобы получить марганец, опять заполняет оболочку 4s и затем одно за другим идет заполнение Зd-оболочки, пока мы не доберемся до меди.
Но так как самая внешняя оболочка марганца, железа, кобальта и никеля имеет одну и ту же конфигурацию, то все они обладают близкими химическими свойствами. (Этот эффект еще сильнее выражен у редкоземельных элементов. У них внешняя оболочка одинакова, а заполняется постепенно внутренняя ячейка, что меньше сказывается на их химических свойствах.) То же и в меди. В ней тоже построение Зd-оболочки завершается грабежом: из 4s-оболочки уводится один электрон. Энергия комбинации 10, 1, однако, настолько близка у меди к энергии комбинации 9, 2, что равновесие может сместиться уже оттого, что поблизости стоит другой атом. По этой причине два последних электрона меди примерно равноценны, и валентность меди равна то 1, то 2. (Временами она проявляет себя так, как если бы ее электроны были в комбинации 9, 2.) Похожие вещи случаются и в других местах таблицы; они-то и ответственны за то, что другие металлы, такие, как железо, соединяются химически то с той, то с другой валентностью. Наконец, у цинка обе оболочки 3d и 4s заполняются раз и навсегда.
От Ga до Kr
От галлия до криптона последовательность опять продолжается нормально, заполняя 4p-оболочку. Внешние оболочки, энергии и химические свойства повторяют картину изменений на участке от бора до неона и от алюминия до аргона.
Криптон, как и аргон или неон, известен как «благородный» газ. Все эти три «благородных» газа химически «инертны»[82]. Это означает только то, что после того, как они заполнили оболочки со сравнительно низкими энергиями, редки будут случаи, когда им станет энергетически выгодно соединиться в простые сочетания с другими элементами. Но для «благородства» недостаточно просто обладать заполненной оболочкой. У бериллия, например, или у магния заполнены s-оболочки, но энергия этих оболочек чересчур высока, чтобы можно было говорить об устойчивости. Точно так же можно было бы ожидать появления другого «благородного» элемента где-то возле никеля, если бы энергия у 3d-оболочки была бы чуть пониже (или у 4s-оболочки повыше). С другой стороны, криптон не вполне инертен; он образует с хлором слабо связанное соединение.
Поскольку в рассмотренной нами части таблицы уже проявились все основные черты периодической системы, мы обрываем наше изложение на элементе № 36 (их остается еще штук 70, а то и больше!).
Мы хотим отметить еще один момент: мы в состоянии понять в какой-то степени не только валентности, но можем кое-что сказать и о направлениях химических связей. Возьмем такой атом, как кислород. В нем четыре 2р-электрона. Первые три попадают в состояния «x», «у» и «z», а четвертый вынужден заполнить одно из них, оставив два других — скажем, «x» и «у» — вакантными. Посмотрите теперь, что происходит в Н2O. Каждый из двух водородов желает разделить свой электрон с кислородом, помогая кислороду заполнить оболочку. Эти электроны будут стремиться попасть на вакансии в состояниях «x» и «y». Поэтому два водорода в молекуле воды обязаны расположиться под прямым углом друг к другу, если смотреть из центра атома кислорода. На самом деле угол равен 105°. Можно даже понять, почему угол больше 90°. Обобществив свои электроны с кислородом, водороды остаются в конце концов с избытком положительного заряда. Электрическое отталкивание «растягивает» волновые функции и разводит угол до 105°. Так же обстоит дело и у H2S. Но атом серы крупнее, атомы водорода оказываются дальше друг от друга, и угол расходится только до 93°. А селен еще крупнее, поэтому в H2Se угол уже совсем близок к 90°.
Аналогичные рассуждения позволяют разобраться в геометрии аммиака H3N. В азоте есть место еще для трех 2р-электронов, по одному на каждое состояние типа «x», «у» и «z». Три водорода будут вынуждены подсоединиться под прямыми углами друг к другу. Углы снова окажутся чуть больше 90°, опять-таки из-за электрического отталкивания, но по крайней мере теперь ясно, отчего молекула H3N не плоская. Углы в фосфине Н3Р уже ближе к 90°, а в H3As еще ближе. Мы не зря предположили, что NH3 не плоский, когда говорили о нем как о системе с двумя состояниями. Именно из-за этой объемности аммиака и возможен аммиачный мазер. Вы видите, что сама форма молекулы аммиака тоже следует из квантовой механики.
Уравнение Шредингера явилось одним из величайших триумфов физики. Снабдив нас ключом к механизму, лежащему в основе строения атома, оно объяснило атомные спектры и всю химию, благодаря чему стала понятна физическая природа материи.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК