§ 1. Молекулярный ион водорода
В предыдущей главе мы обсудили некоторые свойства молекулы аммиака в предположении, что это система о двух состояниях (или двухуровневая система). На самом деле, конечно, это не так — у нее есть множество состояний: вращения, колебания, перемещения и т. д., но в каждом из этих состояний движения следует говорить о паре внутренних состояний из-за того, что атом азота может быть переброшен с одной стороны плоскости трех атомов водорода на другую. Сейчас мы рассмотрим другие примеры систем, которые в том или ином приближении можно будет считать системами с двумя состояниями. Многое здесь будет приближенным, потому что всегда имеется множество других состояний, и в более точном анализе их следовало бы учитывать. Но в каждом из этих примеров мы окажемся в силах очень многое понять, рассуждая только о двух состояниях.
Раз мы будем иметь дело только с двухуровневыми системами, то нужный нам гамильтониан будет выглядеть так же, как и в предыдущей главе. Когда гамильтониан не зависит от времени, то известно, что имеются два стационарных состояния с определенными (и обычно разными) энергиями. В общем случае, однако, мы будем начинать наш анализ с выбора базисных состояний (не обязательно этих стационарных состояний), таких, которые, скажем, имеют другой простой физический смысл. Тогда стационарные состояния системы будут представлены линейной комбинацией этих базисных состояний.
Для удобства подытожим важнейшие уравнения, выведенные в гл. 7. Пусть первоначально в качестве базисных состояний были приняты |1> и |2>. Тогда любое состояние |?> представляется их линейной комбинацией:
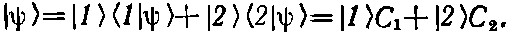 (8.1)
(8.1)
Амплитуды Сi (под этим подразумеваются как C1, так и С2) удовлетворяют двум линейным дифференциальным уравнениям
 (8.2)
(8.2)
где и i, и j принимают значения 1 и 2.
Когда члены гамильтониана Hij не зависят от t, то два состояния с определенной энергией (стационарные), которые мы обозначим

обладают энергиями
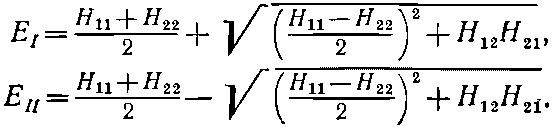 (8.3)
(8.3)
Для каждого из этих состояний оба С имеют одинаковую зависимость от времени. Векторы состояний |I> и |II>, которые отвечают стационарным состояниям, связаны с нашими первоначальными базисными состояниями |1> и |2> формулами
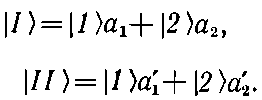 (8.4)
(8.4)
Здесь а —комплексные постоянные, удовлетворяющие равенствам
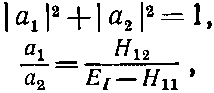 (8.5)
(8.5)
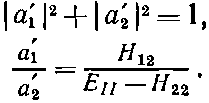 (8.6)
(8.6)
Если H11 и H22 между собой равны, скажем оба равны Е0, а H12=H21=-А, то EI=E0+A, ЕII=Е0-А, и состояния |I> и |II> особенно просты:
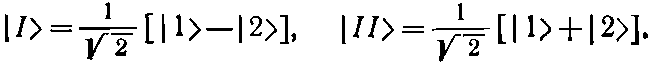 (8.7)
(8.7)
Эти результаты мы хотим теперь использовать, чтобы рассмотреть ряд интересных примеров, взятых из химии и физики. Первый пример — это ион молекулы водорода. Положительно ионизированная молекула водорода состоит из двух протонов и одного электрона, как-то бегающего вокруг них. Каких состояний можно ожидать для этой системы, если расстояние между протонами велико? Ответ вполне ясен: электрон расположится вплотную к одному протону и образует атом водорода в его наинизшем состоянии, а другой протон останется одиночкой, положительным ионом. Значит, когда два протона удалены друг от друга, то можно себе наглядно представить одно физическое состояние, в котором электрон «придан» одному из протонов. Существует, естественно, и другое, симметричное первому состояние, в котором электрон находится возле второго протона, а ионом оказывается первый протон. Эту пару состояний мы и сделаем базисными, обозначив их |1> и |2>. Они показаны на фиг. 8.1.

Фиг. 8.1. Совокупность базисных состояний для двух протонов и электрона.
Конечно, на самом деле у электрона возле протона имеется множество состояний, потому что их комбинация может существовать в виде одного из возбуждённых состояний атома водорода. Но нас сейчас не интересует это разнообразие состояний, мы будем рассматривать лишь случай, когда атом водорода пребывает в наинизшем состоянии — своем основном состоянии, — и пренебрежем на время спином электрона. Мы просто предположим[25], что для всех наших состояний спин электрона направлен вверх по оси z.
Чтобы убрать электрон из атома водорода, требуется 13,6 эв энергии. Столько же энергии — очень много по нашим теперешним масштабам — понадобится и на то, чтобы электрон оказался на полпути между протонами (коль скоро сами протоны сильно удалены друг от друга). Так что по классическим понятиям электрону немыслимо перескочить от одного протона к другому. Однако в квантовой механике это возможно, хоть и не очень вероятно. Существует некая малая амплитуда того, что электрон уйдет от одного протона к другому. Тогда в первом приближении каждое из наших базисных состояний |1> и |2> будет иметь энергию Е0, равную просто сумме энергий атома водорода и протона. Матричные элементы Н11 и H22 гамильтониана мы можем принять приближенно равными Е0. Другие матричные элементы Н12 и Н21, представляющие собой амплитуды перехода электрона туда и обратно, мы опять запишем в виде -А.
Вы видите, что это та же игра, в какую мы играли в последних двух главах. Если пренебречь способностью электрона перескакивать туда и обратно, то два состояния будут иметь в точности одинаковую энергию. Эта энергия, однако, расщепляется на два энергетических уровня из-за того, что электрон может переходить туда и назад, и чем больше вероятность перехода, тем больше расщепление. Стало быть, два уровня энергии системы равны Е0+А и Е0-А, и состояния, у которых такие энергии, даются уравнениями (8.7).
Из нашего решения мы видим, что если протон и водородный ион как-то расположить близко один к другому, то электрон не останется подле одного протона, а будет перескакивать от протона к протону и обратно. Если вначале он был близ одного из протонов, то затем он начнет колебаться туда и назад между состояниями |1> и |2>, давая решение, меняющееся во времени. Чтобы получить решение, отвечающее самой низкой энергии (которое не меняется со временем), необходимо, чтобы вначале система обладала одинаковыми амплитудами пребывания электрона возле каждого из протонов. Кстати, вспомните, что электронов отнюдь не два; мы совсем не утверждаем, что вокруг каждого протона имеется электрон. Имеется только один электрон, и это он имеет одинаковую амплитуду (1/?2 по величине) быть в том или ином положении.
Дальше, для электрона, который находится близ одного протона, амплитуда А оказаться близ другого зависит от расстояния между протонами. Чем они ближе один к другому, тем больше амплитуда. Вы помните, что в гл. 5 мы говорили об амплитуде «проникновения» электрона «сквозь барьер», на что по классическим канонам он не способен. Здесь то же самое положение дел. Амплитуда того, что электрон переберется к другому протону, спадает с расстоянием примерно по экспоненте (для больших расстояний). Раз вероятность, а следовательно, и значение А при сближении протонов возрастают, то возрастает и расстояние между уровнями энергии. Если система находится в состоянии |I>, то энергия Е0+А с уменьшением расстояния растет так, что эти квантовомеханические эффекты приводят к силе отталкивания, стремящейся развести протоны. Если же система пребывает в состоянии |II>, то полная энергия при сближении протонов убывает; существует сила притяжения, подтягивающая протоны один к другому. Эти энергии меняются с расстоянием между протонами примерно так, как показано на фиг. 8.2.
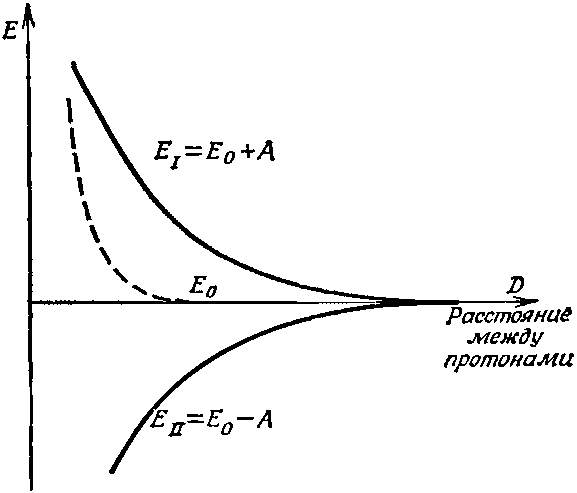
Фиг. 8.2. Энергии двух стационарных состояний иона H2+ как функция расстояния между двумя протонами.
Тем самым у нас появляется квантовомеханическое объяснение силы связи, скрепляющей ион H2+.
Однако мы позабыли об одной вещи. В дополнение к только что описанной силе имеется также электростатическая сила взаимного отталкивания двух протонов. Когда оба протона очень удалены друг от друга (как на фиг. 8.1), то «голый» протон видит перед собой только нейтральный атом, так что электростатической силой можно пренебречь. При очень тесных сближениях, однако, «голый» протон оказывается порой «внутри» электронного распределения, т. е. в среднем он ближе к протону, чем к электрону. Появляется некоторая добавочная электростатическая энергия, которая, конечно, положительна. Эта энергия — она тоже зависит от расстояния — должна быть включена в Е0. Значит, за Е0 мы должны принять нечто похожее на штриховую кривую на фиг. 8.2; она быстро подымается на расстояниях, меньших, чем радиус атома водорода. Энергию переворота А надо вычесть и прибавить к этому Е0. Если это сделать, то энергии ЕI и ЕII будут меняться с межпротонным расстоянием D, как показано на фиг. 8.3.
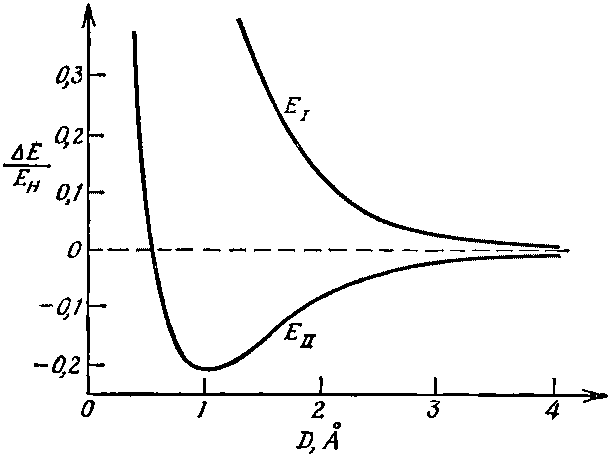
Фиг. 8.3. Уровни энергии иона H2+ как функция межпротонного расстояния D (EH=13,6 эв).
[На рисунке мы воспроизвели результаты более детальных выкладок. Межпротонное расстояние дано в ангстремах (1?=10-8 см), а избыток энергии над протоном плюс водородным ионом дается в единицах энергии связи атома водорода, так называемых «ридбергах» (13,6 эв).] Мы видим, что состояние |II> имеет точку минимума энергии — равновесную конфигурацию (условие наинизшей энергии) для иона Н2+. Энергия в этой точке ниже, чем энергии отдельно протона и отдельно водородного иона, так что система связана. Отдельный электрон действует так, что скрепляет протоны. Химик назвал бы это «одноэлектронной связью».
Этот род химической связи часто также называют «квантовомеханическим резонансом» (по сходству с двумя связанными маятниками, о котором мы уже говорили). Но звучит это таинственнее, чем оно есть на самом деле; это только тогда «резонанс», когда базисные состояния с самого начала неудачно выбраны, как у нас и было! А если выбрать состояние |II>, вы сразу получите наинизшее энергетическое состояние — и все.
Можно и по-иному объяснить, отчего энергия этого состояния должна быть ниже, чем у протона плюс атома водорода. Представим себе электрон возле двух протонов, удаленных на определенное, но не очень большое расстояние. Вы помните, что электрон возле одиночного протона «размазан» из-за принципа неопределенности. Он ищет равновесия, пытаясь раздобыть энергию пониже (низкую кулоновскую потенциальную энергию) и не оказаться при этом сжатым в пространстве чересчур тесно, что привело бы к высокой кинетической энергии (из-за соотношения неопределенности ?р?х??). Если же протонов два, то будет больше места, где у электрона может быть низкая потенциальная энергия. Он может размазаться (снижая тем самым свою кинетическую энергию), не повышая при этом своей потенциальной энергии. В итоге его энергия ниже, чем в атоме водорода. Тогда почему же у другого состояния |I> энергия выше? Но заметьте, что это состояние есть разность состояний |1> и |2>. Вследствие симметрии |1> и |2> разность должна иметь нулевую амплитуду того, что электрон окажется на полпути между протонами. Это означает, что электрон немного сильнее ограничен в пространстве, что и приводит к большей энергии.
Следует сказать, что наше приближенное рассмотрение иона H2+ как двухуровневой системы рассыпается в прах, едва лишь протоны сблизятся до минимума энергии на кривой фиг. 8.3; тогда больше не получается хорошего значения истинной энергии связи. На малых удалениях энергии двух «состояний» на самом деле уже не равны Е0; требуется более тонкое квантовомеханическое рассмотрение.
Положим, мы теперь заинтересуемся, что случилось бы, если бы вместо двух протонов у нас были два разных объекта, скажем один протон и один положительный ион лития (причем обе частицы по-прежнему имеют по единичному положительному заряду). В этом случае два члена Н11 и H22 в гамильтониане больше не совпадали бы; они были бы совершенно различны. Если бы оказалось, что разность (H11-H22) по абсолютной величине много больше А=-H12, то сила притяжения стала бы очень слабой. В этом можно убедиться следующим образом.
Если в (8.3) подставить H12H21=A2, то мы получим
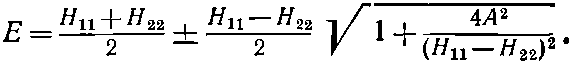
Когда H11-H22 много больше А2, корень довольно точно равен
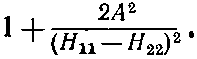
Тогда энергии обращаются в
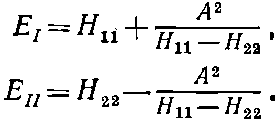 (8.8)
(8.8)
Теперь они почти вплотную совпадают с энергиями H11 и H22 изолированных атомов и только чуть-чуть отличаются из-за наличия амплитуды перескока А.
Разность энергий (ЕI-ЕII) равна

Добавка к расстоянию между уровнями из-за переброса электрона уже не равна 2А; она составляет А /(Н11-Н22) — часть этой величины (что по предположению много меньше единицы). Кроме того, сама зависимость ЕI-ЕII от расстояния между ядрами сейчас намного слабее, чем для иона Н+2: в нее тоже входит множитель А/(Н11-Н22). Можно поэтому понять, отчего связь несимметричных двуатомных молекул, как правило, очень слаба.
В нашей теории иона Н+2 мы открыли объяснение механизма, с помощью которого электрон, распределенный между двумя протонами, создает в итоге силу притяжения между ними даже тогда, когда они очень удалены друг от друга. Сила притяжения проистекает от уменьшения энергии системы, вызываемого тем, что у электрона есть возможность прыгать от одного протона к другому. При таких прыжках система переходит от конфигурации атом водорода — протон к конфигурации протон — атом водорода и обратно. Процесс символически можно записать так:
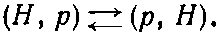
Сдвиг энергии, вызываемый этим процессом, пропорционален амплитуде А того, что электрон с энергией -WH (его энергия связи в атоме водорода) может от одного протона перейти к другому.
При больших расстояниях R между протонами электростатическая потенциальная энергия электрона близка к нулю почти во всем том пространстве, которое он вынужден преодолеть, делая прыжок. Так что в этом пространстве электрон движется почти как свободная частица в пустом пространстве, но обладая при этом отрицательной энергией! В гл. 1 [уравнение (1.7)] мы видели, что амплитуда для частицы определенной энергии перейти с одного места на другое, удаленное на расстояние r, пропорциональна

где р — импульс, отвечающий заданной энергии. В теперешнем случае (применяется нерелятивистская формула) р определяется из выражения
 (8.9)
(8.9)
А это значит, что р —число мнимое:
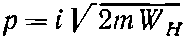
(другой знак перед корнем приводит к абсурду).
Стало быть, следует ожидать, что амплитуда А для иона Н2+ будет меняться как
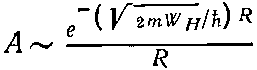 (8.10)
(8.10)
при больших расстояниях R между протонами. Сдвиг энергии, вызываемый электронной связью, пропорционален А; значит, существует сила, сближающая два протона, которая пропорциональна (при больших R) производной от (8.10) по R.
Наконец, для полноты следует заметить, что в одноэлектронной системе с двумя протонами есть еще один эффект, который тоже приводит к зависимости энергии от R. Мы пока им пренебрегали, поскольку он обычно не очень важен, за исключением как раз тех больших расстояний, на которых энергия обменного члена А убывает экспоненциально до очень малых величин. Новый эффект, о котором мы говорим, — это электростатическое притяжение протона к атому водорода, возникающее по той же причине, по какой любой заряженный предмет притягивает к себе незаряженный. «Голый» протон создает электрическое поле ? (изменяющееся как 1/R2) возле нейтрального атома водорода. Атом становится поляризованным, приобретая наведенный дипольный момент ?, пропорциональный ?. Энергия диполя есть ??,т. е. пропорциональна ?2, или 1/R4. Значит, в выражении для энергии системы существует член, убывающий как четвертая степень расстояния (это поправка к e0). Эта энергия спадает с расстоянием медленнее, чем сдвиг А, даваемый формулой (8.10). На каких-то больших расстояниях R член с R4 становится важнейшим, определяющим изменение энергии с R, и поэтому единственной оставшейся силой. Заметьте, что электростатический член для обоих базисных состояний имеет один знак (раз сила притягивает, то энергия отрицательна), а потому и для обоих стационарных состояний его знак один и тот же, в то время как член электронного обмена А для двух стационарных состояний дает разные знаки.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК