Кипение
Кипение
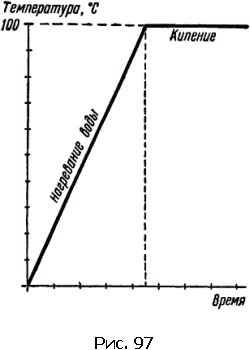
Если опустить термометр в воду, которая налита в чайник, включить электроплитку и следить за ртутью термометра, то мы увидим следующее: почти сразу же уровень ртути поползет кверху. Вот уже 90°, 95°, наконец 100°. Вода закипает, и одновременно прекращается подъем ртути. Вода кипит уже много минут, но уровень ртути не изменяется. Пока вся вода не выкипит, температура не изменится (рис. 97).
На что же идет тепло, если температура воды не меняется? Ответ очевиден. Процесс превращения воды в пар требует энергии.
Сравним энергию грамма воды и грамма образовавшегося из нее пара. Молекулы пара расположены дальше одна от другой, чем молекулы воды. Понятно, что из-за этого потенциальная энергия воды будет отличаться от потенциальной энергии пара.
Потенциальная энергия притягивающихся частиц уменьшается с их сближением. Поэтому энергия пара больше энергии воды, и превращение воды в пар требует энергии. Этот избыток энергии и сообщается электроплиткой воде, кипящей в чайнике.
Энергия, нужная для превращения воды в пар, называется теплотой испарения. Для превращения 1 г воды в пар требуется 539 кал (это цифра для температуры 100 °C). Если 539 кал идет на 1 г, то на 1 грамм-молекулу воды будет затрачено 18·539 = 9700 кал. Такое количество тепла надо затратить на разрыв межмолекулярных связей.
Можно сравнить эту цифру с величиной работы, необходимой для разрыва внутримолекулярных связей. Для того, чтобы одну грамм-молекулу водяного пара расщепить на атомы, требуется около 220 000 кал, т.е. в 25 раз больше энергии. Это непосредственно доказывает слабость сил, связывающих молекулы друг с другом, по сравнению с силами, стягивающими атомы в молекулу.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Кипение растворов
Кипение растворов Явление кипения растворов имеет много общего с явлением замерзания.Наличие растворенного вещества затрудняет кристаллизацию. По тем же самым причинам растворенное вещество затрудняет и кипение. В обоих случаях чужие молекулы как бы борются за