Строение кристаллов
Строение кристаллов
Почему так красива, правильна форма кристалла? Грани его, блестящие и ровные, выглядят так, словно над ними поработал искусный шлифовальщик. Отдельные части кристалла повторяют одна другую, образуя красивую симметричную фигуру.
Ответ на поставленный вопрос может быть лишь один – внешней красоте должна отвечать внутренняя правильность. Эта правильность заключается в многократном повторении одних и тех же основных частей.
Представьте себе парковую решетку, сделанную из прутьев разной длины и расположенных как попало. Безобразная картина. Хорошая решетка построена из одинаковых прутьев, расположенных в правильной последовательности на одинаковых расстояниях один от другого.
Такую же самоповторяющуюся картину мы находим в обоях. Здесь элемент рисунка – скажем, девочка, играющая в мяч, – повторяется уже не в одном направлении, как в парковой решетке, а заполняет плоскость.
Какое же отношение имеют парковая решетка и обои к кристаллу? Самое прямое. Парковая решетка состоит из звеньев, повторяющихся вдоль линии, обои – из картинок, повторяющихся вдоль плоскости, а кристалл – из групп атомов, повторяющихся в пространстве. Поэтому и говорят, что атомы кристалла образуют пространственную (или кристаллическую) решетку.
В настоящее время известно строение многих сотен кристаллов. Расскажем про строение простейших кристаллов и прежде всего тех, которые построены из атомов одного сорта.
Наиболее распространены три типа решеток. Они показаны на рис. 89. Точками изображены центры атомов; линии, объединяющие точки, не имеют реального смысла. Они проведены лишь для того, чтобы сделать читателю более ясным характер пространственного расположения атомов.

Рис. 89, а и 89, б изображают кубические решетки. Чтобы представить себе эти решетки яснее, вообразите, что вы сложили простейшим способом – ребро к ребру, грань к грани – детские кубики.
Если теперь мысленно разместить точки по вершинам и центрам объемов кубов, то возникнет кубическая решетка, изображенная на левом рисунке. Такая структура называется кубической объемноцентрированной. Если разместить точки по вершинам кубов и в центрах их граней, то возникнет кубическая решетка, изображенная на среднем рисунке. Она называется кубической гранецентрированной.
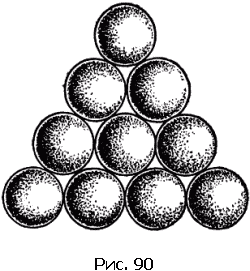
Третья решетка (рис. 89, в) называется плотнейшей гексагональной (т.е. шестиугольной). Чтобы понять происхождение этого термина и яснее представить себе расположение атомов в этой решетке, возьмем биллиардные шары и начнем укладывать их как можно плотнее. Прежде всего составим плотный слой – он выглядит так, как биллиардные шары, собранные «треугольником» перед началом игры (рис. 90). Отметим, что шар внутри треугольника имеет шесть соприкасающихся с ним соседей, и эти шесть соседей образуют шестиугольник. Продолжим укладку наложением слоев друг на друга. Если поместить шары следующего слоя непосредственно над шарами первого слоя, то такая упаковка была бы неплотной. Стараясь разместить в определенном объеме наибольшее число шаров, мы должны положить шары второго слоя в лунки первого, третьего слоя – в лунки второго и т.д. В гексагональной плотнейшей упаковке шары третьего слоя размещены так, что центры этих шаров лежат над центрами шаров первого слоя. Центры атомов в гексагональной плотнейшей решетке расположены так, как центры шаров, плотно уложенных описанным способом.
В описанных трех решетках кристаллизуется множество элементов:
Гексагональная плотнейшая упаковка..... Be, Co, Hf, Ti, Zn, Zr
Кубическая гранецентрированная........ Al, Cu, Co, Fe, Au, Ge, Ni, Ti
Кубическая объемноцентрированная ...... Cr, Fe, Li, Mo, Ta, Ti, U, V
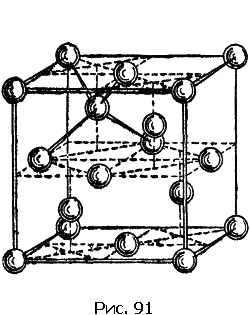
Из других структур упомянем лишь немногие. На рис. 91 изображена структура алмаза. Для этой структуры характерно то, что атом углерода алмаза имеет четыре ближайших соседа. Сопоставим это число с соответствующими числами описанных только что трех наиболее распространенных структур. Как видно из рисунков, в плотнейшей гексагональной упаковке у каждого атома 12 ближайших соседей, столько же соседей у атомов, образующих гранецентрированную кубическую решетку; в объемноцентрированной решетке у каждого атома 8 соседей.
Несколько слов скажем о графите, строение которого показано на рис. 92. Особенность этой структуры бросается в глаза. Графит состоит из слоев атомов, причем атомы одного слоя связаны между собой сильнее, чем атомы соседних слоев. Это связано с величиной межатомных расстояний: расстояние между соседями в одном слое в 2,5 раза меньше кратчайшего расстояния между слоями. Наличие слабо связанных атомных слоев приводит к тому, что кристаллы графита легко расщепляются вдоль этих слоев. Поэтому твердый графит может служить смазочным материалом в тех случаях, когда невозможно применять смазочные масла, – например, при очень низких или очень высоких температурах. Графит – твердый смазочный материал.

Трение между двумя телами сводится, грубо говоря, к тому, что микроскопические выступы одного тела западают во впадины другого. Усилие, достаточное для того, чтобы расщепить микроскопический графитовый кристаллик, много меньше сил трения, поэтому наличие графитовой смазки значительно облегчает скольжение одного тела по другому.
Бесконечно разнообразны структуры кристаллов химических соединений. Крайними – в смысле различий – примерами могут служить структуры каменной соли и двуокиси углерода, изображенные на рис. 93 и 94.
Кристаллы каменной соли (рис. 93) состоят из чередующихся вдоль осей куба атомов натрия (маленькие темные шары) и хлора (большие светлые шары).
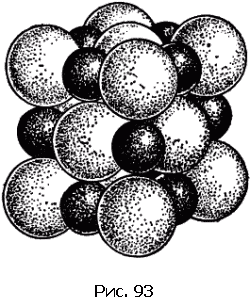
Каждый атом натрия имеет шесть равноотстоящих соседей другого сорта. То же относится и к хлору. Но где же молекула хлористого натрия? Ее нет; в кристалле отсутствует не только группа из одного атома натрия и одного атома хлора, но и вообще какая бы то ни была группа атомов не выделяется своим сближением среди других. Химическая формула NaCl не дает нам оснований говорить, что «вещество построено из молекул NaCl». Химическая формула указывает лишь, что вещество построено из одинакового числа атомов натрия и хлора.
Вопрос о существовании молекул у вещества решается структурой. Если в ней не выделяется группа близких атомов, то молекул нет. Кристаллы без молекул называются атомными.
Кристалл углекислого газа СO2 (сухого льда, который лежит в ящиках у продавщиц мороженого) – пример молекулярного кристалла (рис. 94).
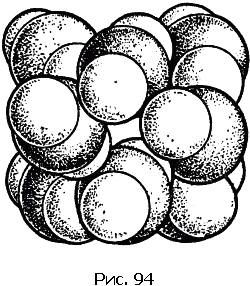
Центры атомов кислорода и углерода молекулы СO2 расположены вдоль прямой линии. Расстояние С–О равно 1,3 ?. А расстояние между атомами кислорода соседних молекул – около 3 ?. Ясно, что при таких условиях мы сразу же «узнаем» молекулу в кристалле.
Молекулярные кристаллы представляют собой плотные упаковки молекул. Чтобы это видеть, надо обрисовать контуры молекулы. Это и сделано на рис. 94.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Глава 3. Строение атома
Глава 3. Строение атома Радиоактивность Блестящая серия физических открытий в последнее десятилетие XIX века поистине явилась началом научной революции. Прологом к ней послужило открытие, сделанное в 1896 году французским физиком Антуаном Анри Беккерелем, который
Строение ядра
Строение ядра Хотя вопрос об излучении ?-частицы казался окончательно выясненным, поскольку закон сохранения электрического заряда выполнялся, физики продолжали свои исследования. Для них оставалось загадкой, как положительно заряженное ядро способно испускать
15. Выращивание кристаллов
15. Выращивание кристаллов Промышленность и наука часто нуждаются в более или менее крупных одиночных кристаллах. Колоссальное значение для техники имеют кристаллы сегнетовой соли и кварца, обладающие замечательным свойством преобразовывать механические действия
17. Истинно твёрдые тела построены из кристаллов
17. Истинно твёрдые тела построены из кристаллов Итак, подавляющее большинство твердых тел имеет кристаллическое строение. Металлы и камни состоят из маленьких кристалликов – зёрен, видимых большей частью только в микроскоп.Свойства кристалликов, их размер, их взаимное
ЛЕКЦИЯ I СВЕЧА. ПЛАМЯ. ЕГО ПИТАНИЕ. ЕГО СТРОЕНИЕ. ПОДВИЖНОСТЬ. ЯРКОСТЬ
ЛЕКЦИЯ I СВЕЧА. ПЛАМЯ. ЕГО ПИТАНИЕ. ЕГО СТРОЕНИЕ. ПОДВИЖНОСТЬ. ЯРКОСТЬ В ответ на любезное внимание, проявленное вами к организованным нами лекциям, я собираюсь изложить вам в следующих беседах ряд сведений по химии, которые можно извлечь из горящей свечи. Я не первый раз
II. Строение атома
II. Строение атома Каждое химическое вещество состоит из однородных частиц, называемых молекулами. Если разложить молекулу на более элементарные составные части, мы получим атомы.Атом принято схематически изображать в виде ядра с вращающимися вокруг него электронами.
Глава 4. Биология. Каково строение и предназначение протеома?
Глава 4. Биология. Каково строение и предназначение протеома? Что такое жизнь? Вспышка светляка в ночи. Дыеание бизона в зимнюю пору. Короткая тень, пробежавшая по траве И потерявшаяся среди заката. Предсмертные слова Вороньей Лапы, вождя племени сиксика[7] Но каким бы ни
Глава 4. Биология. Каково строение и предназначение протеома?
Глава 4. Биология. Каково строение и предназначение протеома? КнигиRaven P. H., Johnson G. В. Biology, 6th Edition. N.Y.: McGraw-Hill, 2002 (на рус. яз.:Рейвн П., Эверт Р., Айкхорн С. Современная ботаника: В 2 т. / Пер. с англ. В. Гладковой и др. М.: Мир, 1990).Узлы Всемирной ПаутиныПрикладная молекулярная
РАДИОАКТИВНОСТЬ И СТРОЕНИЕ АТОМА
РАДИОАКТИВНОСТЬ И СТРОЕНИЕ АТОМА 1.6. Явления радиоактивности, открытые А. Беккерелем в 1896 г. и вслед затем изучавшиеся Пьером и Марией Кюри, Э. Резерфордом и многими другими, сыграли ведущую роль в открытии общих законов строения атома и в подтверждении эквивалентности
X. Строение вещества
X. Строение вещества Молекулы Молекулы состоят из атомов. Атомы связаны в молекулы силами, которые называют химическими силами.Существуют молекулы, состоящие из двух, трех, четырех атомов. Крупнейшие молекулы – молекулы белков – состоят из десятков и даже сотен тысяч
4.2. Физические характеристики, строение ядра
4.2. Физические характеристики, строение ядра В последнее десятилетие наши знания о кометах и о процессах, происходящих на них, значительно расширились. Резкому повышению интереса к кометам способствовали подготовка и проведение международного космического