Атомы
Атомы
Около 2000 лет назад в Древнем Риме была написана оригинальная поэма. Ее автором был римский поэт Лукреций Кар. «О природе вещей» – так называлась поэма Лукреция.
Звучными стихами рассказал Лукреций в своем поэтическом произведении о взглядах древнегреческого философа Демокрита на мир.
Что это были за взгляды? Это было учение о мельчайших, невидимых частичках, из которых построен весь наш мир. Наблюдая различные явления, Демокрит пытался дать им объяснение.
Вот, например, вода. При сильном нагревании она превращается в невидимый пар и улетучивается. Как это можно объяснить? Ясно, что такое свойство воды связано с ее внутренним строением.
Или почему, например, мы ощущаем запахи цветов на расстоянии?
Размышляя над подобными вопросами, Демокрит пришел к убеждению, что тела только кажутся нам сплошными, на самом же деле они состоят из мельчайших частиц. У различных тел эти частицы различны по форме, но они настолько малы, что увидеть их невозможно. Поэтому-то любое тело и кажется нам сплошным.
Демокрит назвал такие мельчайшие, неделимые далее частички, из которых состоят вода и все другие тела, «атомами», что по-гречески означает «неделимые».
Замечательная догадка древнегреческих мыслителей, родившаяся 24 века назад, позднее была надолго забыта. Более тысячи лет в ученом мире безраздельно господствовало ошибочное учение Аристотеля.
Утверждая, что все вещества могут взаимно превращаться друг в друга, Аристотель категорически отрицал существование атомов. Любое тело можно делить до бесконечности, – учил Аристотель.
В 1647 году француз Пьер Гассенди издал книгу, в которой смело отрицал учение Аристотеля и утверждал, что все вещества в мире состоят из неделимых частичек – атомов. Атомы отличаются друг от друга формой, величиной и весом.
Соглашаясь с учением древних атомистов, Гассенди развил это учение дальше. Он объяснил, каким именно образом могут возникать и возникают в мире миллионы разнообразных тел природы. Для этого, утверждал он, не нужно большого числа различных атомов. Ведь атом – это все равно что строительный материал для домов. Из трех различных видов стройматериалов – кирпичей, досок и бревен – можно построить огромное число самых разнообразных домов. Точно так же из нескольких десятков различных атомов природа может создать тысячи разнообразнейших тел. При этом в каждом теле различные атомы соединяются в небольшие группы; эти группы Гассенди назвал «молекулами», т.е. «массочками» (от латинского слова «молес» – масса).
Молекулы различных тел отличаются одна от другой числом и видом («сортом») входящих в них атомов. Нетрудно сообразить, что из нескольких десятков различных атомов можно создать огромное количество различных их комбинаций – молекул. Вот почему так велико разнообразие окружающих нас тел.
Однако еще многое во взглядах Гассенди было ошибочно. Так, он считал, что имеются особые атомы для тепла, холода, вкуса и запаха. Как и другие ученые того времени, он не мог полностью освободиться от влияния Аристотеля, признавал его невещественные элементы.
В сочинениях М.В. Ломоносова – великого просветителя и основателя науки в России – содержатся следующие мысли, получившие подтверждение на опыте много позднее.
Ломоносов пишет, что молекула может быть однородной и разнородной. В первом случае в молекуле группируются однородные атомы. Во втором – молекула состоит из атомов, отличных один от другого. Если какое-либо тело составлено из однородных молекул, то его надо считать простым. Наоборот, если тело состоит из молекул, построенных из различных атомов, Ломоносов называет его смешанным.
Теперь мы хорошо знаем, что различные тела природы имеют именно такое строение. В самом деле, возьмем, например, газ кислород; в каждой его молекуле содержится по два одинаковых атома кислорода. Это молекула простого вещества. Если же атомы, составляющие молекулы, различны, – это уже «смешанное», сложное химическое соединение. Молекулы его состоят из атомов тех химических элементов, которые входят в состав этого соединения.
Можно сказать и иначе – каждое простое вещество построено из атомов одного химического элемента; сложное вещество включает в себя атомы двух и более элементов.
Ряд мыслителей говорили об атомах, приводя логические доводы в пользу их существования. По-настоящему ввел атомы в науку и сделал их предметом исследования английский ученый Дальтон. Дальтон показал, что существуют химические закономерности, которые можно объяснить, лишь используя представления об атомах.
После Дальтона атомы прочно вошли в науку. Однако еще очень долго находились ученые, которые «не верили в атомы». Один из них писал уже в самом конце прошлого века, что через несколько десятилетий атомы «удастся разыскать лишь в пыли библиотек».
Сейчас подобные суждения кажутся смешными. Мы знаем сейчас так много подробностей о «жизни» атома, что сомневаться в его существовании – все равно, что подвергать сомнению реальность Черного моря.
Относительные веса атомов определили химики. Сначала за единицу атомного веса был принят вес атома водорода. Атомный вес азота оказался равным примерно 14, кислорода – примерно 16, хлора – примерно 35,5. Впоследствии был сделан несколько иной выбор относительных единиц атомного веса, в которых число 16,0000 приписывалось природному кислороду. Атомный вес водорода оказался равным в этой шкале 1,008. В настоящее время при определении этих единиц исходят из веса атома углерода – 12.
В результате ряда интересных опытов физикам удалось измерить абсолютный вес атомов. Так как относительные веса известны, то достаточно измерить в граммах вес атома какого-либо одного сорта, например водорода.
Разумеется, физики не изготовляли весов, на которые можно положить один атом и уравновесить гирькой. Для определения веса атомов физики пользовались другими измерениями, однако ничуть не менее достоверными, чем прямое взвешивание.
Единица атомного веса оказалась равной:
m = 1,66·10?24 г.
Чтобы представить себе малость этой цифры, вообразите, что у каждого человека на земном шаре (а население Земли – более двух миллиардов) вы потребуете по миллиарду молекул. Сколько же вещества соберете вы таким образом? Несколько миллионных долей грамма.
Или еще такое сравнение: земной шар во столько раз тяжелее яблока, во сколько раз яблоко тяжелее атома водорода.
Обратная величина от m называется числом Авогадро:
N = 1/m = 6,023·1023.
Это скромное число имеет следующий смысл. Возьмем вещество в таком количестве, чтобы число граммов равнялось относительному весу атома или молекулы М. Такое количество называется 1 грамм-атом или 1 грамм-молекула (часто для краткости вместо «грамм-молекула» говорят «моль»). Вес молекулы в граммах равен Мm. Поэтому число молекул в грамм-молекуле любого вещества
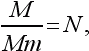
т.е. равно числу Авогадро.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Глава III. Атомы и частицы
Глава III. Атомы и частицы 1. Атомная структура материи Хорошо известно, что древние мыслители неоднократно высказывали предположение о дискретной природе материи. Они пришли к этому, исходя из философской идеи о том, что невозможно осознать бесконечную делимость материи
Глава 1 АТОМЫ В ДВИЖЕНИИ
Глава 1 АТОМЫ В ДВИЖЕНИИ § 1. Введение§ 2. Вещество состоит из атомов§ 3. Атомные процессы§ 4. Химические реакции§ 1. ВведениеЭтот двухгодичный курс физики рассчитан на то, что вы, читатель, собираетесь стать физиком. Положим, это не так уж обязательно, но какой преподаватель
III. Откуда берутся атомы?
III. Откуда берутся атомы? Рождение элементов (t = 1 секунда — 3 минуты)Мы уже очень далеко уклонились от первоначального вопроса крошки Билли «Откуда я взялся?»[115], зато теперь готовы дать на него ответ получше.Сначала надо рассказать малышу, из чего он на самом деле сделан.
Свет и атомы
Свет и атомы Почему атомы светятся? Свет рождается в веществе. Таково происхождение и видимого света, и инфракрасного, и ультрафиолетового, и рентгеновских излучений, и гамма-излучений. Естественно, что, изучая свойства света, можно в конечном счете узнать, при каких
Почему атомы светятся?
Почему атомы светятся? Свет рождается в веществе. Таково происхождение и видимого света, и инфракрасного, и ультрафиолетового, и рентгеновских излучений, и гамма-излучений. Естественно, что, изучая свойства света, можно в конечном счете узнать, при каких условиях атомы
Почему атомы устойчивы?
Почему атомы устойчивы? По законам механики электрон в атоме необходимо должен обращаться вокруг ядра. Иначе он упадет на ядро, с атомом произойдет какая-то катастрофа. В самом деле, массивное положительно заряженное ядро притягивает отрицательно заряженный электрон,
Как атомы обмениваются энергией?
Как атомы обмениваются энергией? В первом опыте были взяты пары ртути. Энергия снарядов-электронов увеличивалась постепенно. Оказалось, что при малых энергиях электронов никакого возбуждения атомов ртути не наступало. Электроны ударяли в них, но отскакивали с той же
10. Одни и те же атомы, но разные кристаллы
10. Одни и те же атомы, но разные кристаллы Чёрный матовый мягкий графит, которым мы пишем, и блестящий прозрачный твёрдый, режущий стекло алмаз построены из одних и тех же атомов, а именно, атомов углерода. Почему так резко различны свойства этих двух сходных по составу
Атомы, физика и этика
Атомы, физика и этика Самая первая перестройка фундамента физики произошла после двух веков царствования порядка, открытого Ньютоном. Главную роль в той перестройке сыграл Джеймс Максвелл, и эту роль трудно переоценить именно потому, что он ввел первое новое
Глава вторая. Атомы
Глава вторая. Атомы Физические явления, происходящие в окружающем нас мире, представляют бесконечную цепь загадок. Вода, охлаждаясь, превращается в твердый, бесцветный лед, нагреваясь же, становится невидимым водяным паром. Если ее слегка подкислить серной кислотой и
Атомы
Атомы Около 2000 лет назад в Древнем Риме была написана оригинальная поэма. Ее автором был римский поэт Лукреций Кар. «О природе вещей» – так называлась поэма Лукреция.Звучными стихами рассказал Лукреций в своем поэтическом произведении о взглядах древнегреческого
Одни и те же атомы, но разные кристаллы
Одни и те же атомы, но разные кристаллы Черный матовый мягкий графит, которым мы пишем, и блестящий прозрачный, твердый, режущий стекло алмаз построены из одних и тех же атомов – атомов углерода. Почему же так различны свойства этих двух одинаковых по составу
III. Откуда берутся атомы?
III. Откуда берутся атомы? Рождение элементов (t = 1 секунда – 3 минуты)Мы уже очень далеко уклонились от первоначального вопроса крошки Билли «Откуда я взялся?»[116], зато теперь готовы дать на него ответ получше. Сначала надо рассказать малышу, из чего он на самом деле сделан.