Скорости молекул
Скорости молекул
Теория указывает, что при одной температуре средние кинетические энергии молекул mvср2/2 одинаковы. При нашем определении температуры эта средняя кинетическая энергия поступательного движения молекул газа пропорциональна абсолютной температуре. В виде равенства этот важнейший закон записывается так:

где энергия измеряется в эргах.
Мы уже поняли ранее, что температура является какой-то мерой интенсивности теплового движения. Теперь же мы видим, что измерение температуры термометром, заполненным идеальным газом, придает этой мере на редкость простой смысл. Температура пропорциональна среднему значению энергии поступательного движения молекул.
Определим среднюю скорость молекул кислорода при комнатной температуре, которую мы для круглого счета примем в 27 °C = 300 K. Молекулярный вес кислорода 32, так что вес одной молекулы равен 32/6·1023. Простое вычисление даст vср = 4,8·104 см/с, т.е. около 500 м/с. Существенно быстрее движутся молекулы водорода. Их массы в 16 раз меньше и скорости в sqrt(16) = 4 раза больше, т.е. при комнатной температуре составляют около 2 км/с. Прикинем, с какой тепловой скоростью движется маленькая, видимая в микроскоп частичка. Обычный микроскоп позволяет увидеть пылинку диаметром в 1 микрон (10?4 см), Масса такой частицы при плотности, близкой к единице, будет что-нибудь около 5·10?13 г. Для ее скорости получим около 0,5 см/с. Неудивительно, что такое движение вполне заметно.
Скорость броуновского движения горошины с массой в 0,1 г будет уже всего только 10?6 см/с. Немудрено, что мы не видим броуновского движения таких частиц.
Мы говорили о средних скоростях молекулы. Но ведь не все молекулы движутся с одинаковыми скоростями, какая-то доля молекул движется быстрее, а какая-то медленнее. Все это, оказывается, можно рассчитать. Приведем только результаты.
При температуре около 15 °C, например, средняя скорость молекул азота равна 500 м/с; со скоростями от 300 до 700 м/с движется 59 % молекул. С малыми скоростями – от 0 до 100 м/с – движется всего лишь 0,6 % молекул, Быстрых молекул со скоростями свыше 1000 м/с в газе всего лишь 5,4 % (рис. 96).
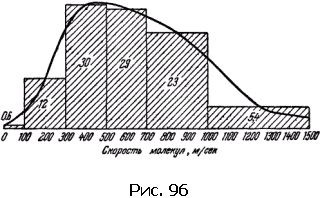
Можно рассчитать и распределение молекул по разным значениям энергии поступательного движения.
Число молекул, энергия которых более чем в два раза превосходит среднюю, уже меньше 10 %. Доля еще более «энергичных» молекул тает по мере увеличения энергии во все возрастающей степени. Так, молекул, энергия которых в 4 раза больше средней, – всего 0,7 %, в 8 раз больше средней – 0,06·10?4 %, в 16 раз больше средней – 2·10?8 %.
Энергия молекулы кислорода, движущейся со скоростью 11 км/с, равна 32·10?12 эрг. Средняя энергия молекулы при комнатной температуре равна всего 6·10?14 эрг.
Таким образом, энергия «одиннадцатикилометровой молекулы» по крайней мере в 500 раз больше энергии молекулы со средней скоростью. Неудивительно, что доля молекул со скоростями выше 11 км/с равна невообразимо малому числу – порядка 10?300.
Но почему нас заинтересовала скорость 11 км/с? На стр. 161 мы говорили о том, что оторваться от Земли могут лишь тела, имеющие эту скорость. Значит, забравшиеся на большую высоту молекулы могут потерять связь с Землей и отправиться в далекое межпланетное путешествие, но для этого надо иметь скорость 11 км/с. Доля таких быстрых молекул, как мы видим, настолько ничтожна, что опасность потери атмосферы Земле не грозит даже через миллиарды лет.
Скорость ухода атмосферы необычайно сильно зависит от гравитационной энергии ?(Mm/r).Если средняя кинетическая энергия молекулы во много раз меньше гравитационной энергии, то отрыв молекул практически невозможен. На поверхности Луны гравитационная энергия в 20 раз меньше, что дает для энергии «убегания» молекулы кислорода значение 1,5·10?12 эрг. Это значение превышает величину средней кинетической энергии молекулы всего лишь в 20–25 раз. Доля молекул, способных оторваться от Луны, равна 10?17. Это уже совсем не то, что 10?300, и подсчет показывает, что воздух будет довольно быстро уходить с Луны в межпланетное пространство. Неудивительно, что на Луне нет атмосферы.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Скорости капризничают
Скорости капризничают Какую скорость имеет пассажир относительно полотна железной дороги, если он идет к голове поезда со скоростью 5 километров в час, а поезд движется со скоростью 50 километров в час? Ясно, что скорость человека относительно полотна дороги равна 50 + 5 = 55
Вычисление скорости
Вычисление скорости Вычисление начальной скорости ядра, которое никогда не должно упасть на Землю. Чтобы найти искомую скорость, спросим себя сначала: почему всякое ядро, выброшенное пушкой горизонтально, в конце концов, падает на Землю? Потому что земное притяжение
9. Упаковка молекул
9. Упаковка молекул Характерная особенность описанных выше кристаллов – это отсутствие молекулы в кристалле. Кристалл построен из атомов или ионов, и выделить молекулу в кристалле нельзя. Действительно, вернёмся, например к рисунку 24, а, изображающему строение кристалла
5. Распределение Максвелла (распределение газовых молекул по скоростям) и Больцмана
5. Распределение Максвелла (распределение газовых молекул по скоростям) и Больцмана Распределение Максвелла – в равновесном состоянии параметры газа (давление, объем и температура) остаются неизменными, однако микросостояния – взаимное расположение молекул, их
31. Разновидность пассивного переноса молекул и ионов через биологические мембраны
31. Разновидность пассивного переноса молекул и ионов через биологические мембраны Простая диффузия через липидный слой в живой клетке обеспечивает прохождение кислорода и углекислого газа. Ряд лекарственных веществ и ядов также проникает через липидный слой. Однако
2. Вычисление скорости света
2. Вычисление скорости света Впервые идея о способе измерения скорости света была высказана Г. Галилеем в 1607 г. в следующем виде. Два наблюдателя с фонарями находятся на известном друг от друга расстоянии в прямой видимости. Первый из них открывает свой фонарь и, отмечая
4.7. Измерение скорости света Солнца
4.7. Измерение скорости света Солнца В конце 40-х гг. ХХ века, во время подготовки в СССР дискуссии о сущности теории относительности, С. И. Вавиловым, президентом АН СССР, было решено поставить лабораторный опыт по проверке достоверности постулата с = const. В качестве
6.3. Рост массы в зависимости от скорости
6.3. Рост массы в зависимости от скорости Представление зависимости массы от скорости занимает особое положение в современной физике. История формирования соотношения между массой и энергией изложена В. В. Чешевым в работе [1], где, в частности, сказано: «Представление о
Глава 1 Ограничение скорости
Глава 1 Ограничение скорости В тот день все банки были закрыты — выходной, и мистер Томпкинс, скромный служащий солидного городского банка, встал позже обычного и не спеша позавтракал. Пора было позаботиться о досуге, и мистер Томпкинс решил, что было бы неплохо сходить
Как складывать скорости
Как складывать скорости Если я ждал полчаса и еще час, то всего я потерял времени полтора часа. Если мне дали рубль, а затем еще два, то я всего получил три рубля. Если я купил 200 г винограда, а затем еще 400 г, то у меня будет 600 г винограда. Про время, массу и другие подобные
Взаимодействие молекул
Взаимодействие молекул Молекулы взаимно притягиваются, в этом невозможно сомневаться. Если бы в какое-то мгновение молекулы перестали притягиваться друг к другу, все жидкие и твердые тела распались бы на молекулы.Молекулы взаимно отталкиваются, и это несомненно, так как